
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、___________、___________。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是___________。
A.50 mL 0.50 mol·L-1 NaOH溶液 B.50 mL 0.55 mol·L-1 NaOH溶液 C.1.0 g NaOH固体
(3)实验时大烧杯上若不盖硬纸板,求得中和热ΔH的数值 (填偏大、偏小、无影响)。
(4)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/ kJ·mol-1 |
A.1.0 mol/L HCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | 19.8 ℃ | ΔH1 |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | 19.3 ℃ | ΔH2 |
① 设充分反应后溶液的比热容c=4.18 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1= ;ΔH2= 。(已知溶液密度 均为1 g/cm3)
② ΔH1 ≠ ΔH2原因是 。
【答案】(1)环形玻璃搅拌棒 量筒
(2)B (3)偏大 (2分)
(4)① -56.8 kJ/mol -52.7 kJ/mol
② NaOH是强碱,NH3·H2O是弱碱电离吸热
【解析】
试题分析:(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂等体积但浓度略大的NaOH溶液,使碱过程或酸完全中和,并且根据酸的浓度和体积计算生成水的物质的量,答案选B;(3)实验时大烧杯上若不盖硬纸板,则中和放出的热量散失得多,温度计测得的温度偏小,中和反应放出的热量偏小,由![]() 可知,计算出的中和热ΔH偏大;(4)① 由ΔH = -
可知,计算出的中和热ΔH偏大;(4)① 由ΔH = -![]() kJ/mol = -
kJ/mol = - ![]() kJ/mol = -56.8 kJ/mol;② 由ΔH = -
kJ/mol = -56.8 kJ/mol;② 由ΔH = -![]() kJ/mol = -
kJ/mol = - ![]() kJ/mol = -52.7 kJ/mol ;(5)ΔH1 ≠ ΔH2原因是NaOH是强碱,NH3·H2O是弱碱, NH3·H2O电离出OH-时需要吸热,导致中和反应放出的热量减小,导致中和热ΔH的值偏高。
kJ/mol = -52.7 kJ/mol ;(5)ΔH1 ≠ ΔH2原因是NaOH是强碱,NH3·H2O是弱碱, NH3·H2O电离出OH-时需要吸热,导致中和反应放出的热量减小,导致中和热ΔH的值偏高。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】有关金属腐蚀的论述,正确的是( )
A. 金属的腐蚀一定伴有电流产生
B. Fe在干燥的空气里比在潮湿的空气里更易被腐蚀
C. 发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D. 发生电化腐蚀时都有能量的转变,且被腐蚀的金属总是失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2 H2(g) ![]() CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是( )
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是( )

A.T1 > T2
B.该反应的ΔH > 0
C.T1时的平衡常数K1 < T2时的平衡常数K2
D.T1时的平衡常数K1 > T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.lmol/LCH3COOH溶液可使紫色石蕊变红
C. CH3COOH溶液与Na2C03反应生成C02
D. O.lmol/LCH3COONa溶液的pH大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应A(g)+B(g) ![]() n C(g) ΔH < 0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
n C(g) ΔH < 0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
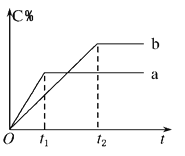
A.反应由逆反应开始
B.a表示有催化剂,b表示无催化剂
C.若n=2,其他条件相同,a比b的压强大
D.若其他条件相同,a比b的温度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是一种国际基本物理量
B.标准状况下气体摩尔体积约为22.4 L
C.在同温同压下,相同体积的任何单质所含分子数相同
D.1 mol氧原子的质量为16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:

(1)写出OA段所发生反应的离子方程式_____________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2![]() Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3
Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3![]() Si3N4+12HCl。则下列叙述正确的是( )
Si3N4+12HCl。则下列叙述正确的是( )
A.反应②属于离子反应
B.若制取等量的Si3N4,则反应①②转移电子数目必然相等
C.反应①的氧化剂是N2
D.反应①中氧化产物与还原产物物质的量之比为1∶6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com