

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¶��£�0.0l mol��L������Һ��pH��4 |
| B�����¶��£���0.1 mol/L�����0.01 mol/L����ֱ���ȫ�к͵����0.1 mol/L��NaOH��Һ������������������Ϊ1��10 |
| C�����¶��£�0.2 mol��L������Һ��0.4 mol��L��������Һ�������Ϻ��Һ��pH��4.7 |
| D�����¶��£�0.2 mol��L������Һ��0.4 mol��L��������Һ�������Ϻ��Һ��pH=4.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ƾ���ȼ����ΪQ3 kJ |
| B����ʹ46 g�ƾ�Һ����ȫȼ�գ����ָ������£��ͷų�������Ϊ��3Q1��Q2��Q3��kJ |
| C��H2O(g)��H2O(l)�ͷų������������Ըù���Ϊ��ѧ�仯 |
| D���ӷ�Ӧ�ۿ�֪1mol C2H5OH(g)��������2 mol CO2(g)��3 mol H2O(g)�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/L | B��1��10-3 mol/L | C��1��10-7 mol/L | D��1��10-11 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ˮϡ�ͣ���Һ��c(H+)��c(OH-)�ij˻����� |
| B����������ƹ��壬����Һ������ʱc(Na+)=c(CH3COO-) |
| C������Һ����ˮ���������c(OH-)=1��10-12mol/L |
| D����0.01mol/L NaOH�к�ͬ���ͬpH������ʹ�������NaOH�����V(����)��V(����) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������ˮ�������������á��Ҵ����Ͷ��漰���������ܵ����� |
| B�����ϣȼ�շ������۷���ͭ˿ȼ�շ���ֽ����������Ԫ�ض��Է����� |
| C���ֽ�������������֡�ʯ���ߡ�̼��ά��ǿ�մɶ��dz����ĸ��ϲ��� |
| D��Һ�����������绯���ۻ��ȶ��������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
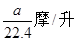 B��
B��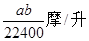 C
C 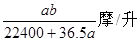 D��
D��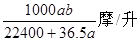
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ڢ� | C���ڢ� | D��ֻ�Т� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com