
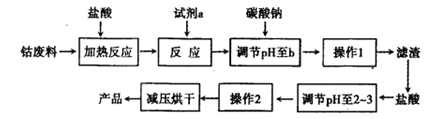
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:实验题
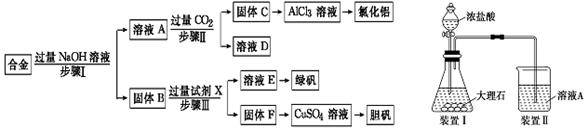
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用NH3·H2O溶液鉴别Al3+、Mg2+和Ag+ |
| B.用Ba(NO3)2溶液鉴别Cl—、SO2—4和CO2—3 |
| C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D.用新制氢氧化铜悬浊液鉴别甲醛和甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
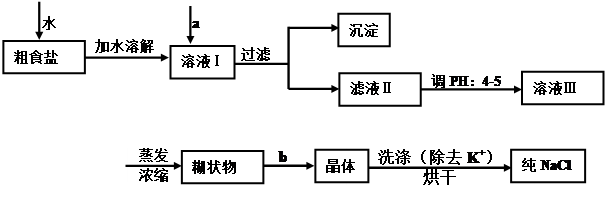
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙酸(乙醛):加入新制的氢氧化铜,加热 |
| B.苯(苯酚):加入溴水,过滤 |
| C.溴乙烷(溴单质):加入热氢氧化钠溶液洗涤,分液 |
| D.乙酸乙酯(乙酸):加入饱和碳酸钠溶液洗涤,分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

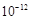
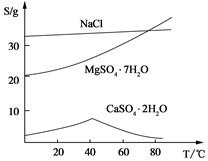
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com