
 .
. 分析 (1)依据一定物质的量浓度溶液的配制方法以及仪器的选择回答即可,依据灼烧需要的仪器选择即可;
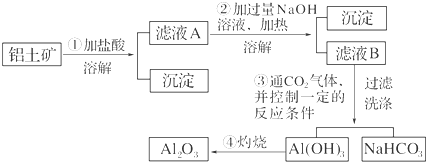
(2)氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;
(3)依据滤渣的洗涤方法解答即可;
(4)二氧化碳不足量时,只发生CO2和NaOH的反应;
除去CO2中的HCl用饱和NaHCO3溶液,且洗气装置中导气管遵循“长进短出”原则.
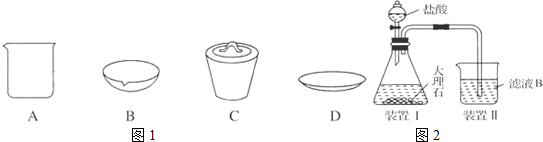
解答 解:(1)在实验中需用1mol•L-1的NaOH溶液480mL,但是实验室中无480mL的容量瓶,依据“大而近”的仪器选择原则,故应选取500mL容量瓶,配制该溶液需要溶解固体,故还需要烧杯,灼烧需要耐高温的材料,故选择坩埚,
故答案为:500mL容量瓶、烧杯;坩埚;
(2)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.①氧化铝与盐酸反应生成氯化铝和水,离子反应方程式为:Al2O3+6H+═2Al3++,氧化铁与盐酸反应生成氯化铁与水,离子反应方程式为:Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe2O3+6H+═2Fe3++3H2O、Al2O3+6H+═2Al3++3H2O;
(3)滤渣的洗涤方法为:沿玻璃棒向漏斗中注入少量水,使水面浸过沉淀物,并不漫过滤纸边缘,等水滤出后,再次加水洗涤,反复几次,即可把固体洗涤干净,
故答案为:向过滤器中加入蒸馏水,使水刚好没过沉淀物,等水自然流尽后,重复操作2~3次;
(4)滤液中含有过量的NaOH,二氧化碳不足量时,先发生CO2和NaOH的反应,所以该同学解释合理,离子方程式为2OH-+CO2=CO32-+H2O,除去CO2中的HCl用饱和NaHCO3溶液,且洗气装置中导气管遵循“长进短出”原则,该装置图为 ,
,
故答案为:合理;2OH-+CO2=CO32-+H2O; .
.
点评 本题考查用铝土矿提取氧化铝,理解工艺流程是解题的关键,平时注意分析问题、解决问题的能力的培养,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2→Al(OH)3→Al | B. | N2→NO2→HNO3 | ||
| C. | NaOH→Na2CO3→NaHCO3 | D. | FeS2→SO3→H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与稀盐酸混合:CO32-+2H+=CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4?Na++H++SO42- | B. | HCO3-+H2O═H3O++CO32- | ||
| C. | HClO═H++ClO- | D. | H2S?H++HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑧ | B. | ①②④⑦ | C. | ③⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com