
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |
分析 A、A的质量不变,说明A的物质的量不变,正逆反应速率相等;
B、若D为气体,再加入1mol A,相当于增大压强,平衡逆向移动;
C、正反应是放热反应,温度升高,平衡常数减小;
D、若D为固体,再加入1mol A,A要转化为B、D,所以平衡要正向移动,移动的结果向减弱A的方向移动;
解答 解:A、A的质量不变,说明A的物质的量不变,正逆反应速率相等,反应达平衡状态,故A正确;
B、若D为气体,再加入1mol A,相当于增大压强,平衡逆向移动,A的转化率减小,故B错误;
C、正反应是放热反应,温度升高,平衡常数减小,而不是增大,故C错误;
D、若D为固体,再加入1mol A,A要转化为B、D,所以平衡要正向移动,移动的结果向减弱A的方向移动,而不是不移动,故D错误;
故选A.
点评 本题考查了影响化学平衡的因素,难度不大,注意可逆反应的特点,易错的是选项B,难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解的产物是高级脂肪酸和丙三醇 | |
| B. | 油脂属于混合物 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
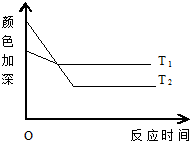 反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):
反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 阴极发生还原反应,正极亦发生还原反应 | |
| C. | Cl2与碱溶液的反应,实质是HClO与OH-的反应 | |
| D. | 从氯水中分离出HClO,可加入CaCO3蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
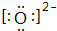 ;
;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CDEBA | B. | ECDAB | C. | BAEDC | D. | CDBAE |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com