
����Ŀ��������Ҫ�ĵ��ʣ��ϳ�ԭ��Ϊ�� N2(g)+3H2(g)![]() 2NH3(g) ��H= ��92.4 kJ/mol����500�桢20 MPaʱ����N2��H2����һ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����Ӧ�����и������ʵ����仯��ͼ���ش��������⣺
2NH3(g) ��H= ��92.4 kJ/mol����500�桢20 MPaʱ����N2��H2����һ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����Ӧ�����и������ʵ����仯��ͼ���ش��������⣺
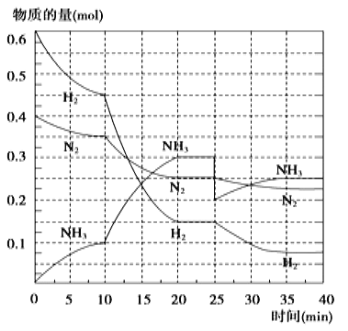
��1��10 min����NH3��ʾ��ƽ����Ӧ���ʣ�______��
��2����10 ~20 min�ڣ�NH3Ũ�ȱ仯��ԭ�������______________
A�����˴��� B����С������� C�������¶� D������NH3���ʵ���
��3����1��ƽ���ƽ�ⳣ��K1 = _________________�������ݵı���ʽ������2��ƽ��ʱNH3���������=___________��С�������һλ����
��4���ڷ�Ӧ������25 minʱ�������߷����仯��ԭ��______________���� ��ڶ���ƽ��ʱ����ƽ���ƽ�ⳣ��K2 ____ K1������������������������С��������
���𰸡�0.005 mol/(L��min) A ![]() 45.5 % ����0.1 mol NH3 ����
45.5 % ����0.1 mol NH3 ����
��������
(1)���ݷ�Ӧ����= ![]() ���㣻
���㣻
(2)����ͼ��֪����Ӧ���ʼӿ죬��10minʱ����������ʵ����������ģ�������������ı仯���ж�ƽ��ʩ�ʷ����ƶ����ٽ��Ӱ��ƽ������ط������
(3)��ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���2��ƽ��ʱ������NH3������������ڰ��������ʵ����������㣻
(4)25���ӣ�NH3�����ʵ���ͻȻ���٣���H2��N2�����ʵ������䣬˵��Ӧ�Ƿ����NH3������ƽ�ⳣ����Ӱ�����ط����жϡ�
(1)��Ӧ����v(NH3)= ![]() =
= ![]() =0.005mol/(L��min)���ʴ�Ϊ��0.005mol/(L��min)��
=0.005mol/(L��min)���ʴ�Ϊ��0.005mol/(L��min)��
(2)��ͼ���֪����������ʵ����仯���ӣ�����Ӧ���ʼӿ죬��10minʱ�仯�������ģ�20min��ƽ��ʱ����n(N2)=0.35mol-0.25mol =0.1mol����n(H2)=0.45mol-0.15mol=0.3mol����n(NH3)=0.3mol-0.1mol =0.2mol�����ʵ����仯֮�ȵ��ڻ�ѧ������֮�ȣ������������ʵ��������ӱ�����ͬ��˵��10min���ܸı��������ʹ�ô�������С����൱������ѹǿ��Ӧ�÷�Ӧ����������ӱ������������¶ȣ�Ӧ�÷�Ӧ���ʼ�С������NH3���ʵ������淴Ӧ�������ӵı���������ֻ��ʹ�ô������ϣ���ѡA��
(3)��ͼ����Կ���������Ӧ���е�ʱ20-25min�������ʵ������䣬˵����Ӧ�ﵽƽ��״̬����ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���ͼ���֪��20min��ƽ��ʱ��n(N2)=0.025mol��10=0.25mol��n(H2)=0.025mol��6=0.15mol��n(NH3)=0.025mol��12=0.3mol������������ƽ�ⳣ��K= ![]() =
=  =
=![]() ��35minʱ�ﵽ��2��ƽ����NH3���������=
��35minʱ�ﵽ��2��ƽ����NH3���������= ![]() ��100%=45.5%���ʴ�Ϊ��
��100%=45.5%���ʴ�Ϊ��![]() ��45.5%��
��45.5%��
(4)��25���ӣ�NH3�����ʵ���ͻȻ���٣���H2��N2�����ʵ������䣬˵��Ӧ�Ƿ����NH3����ͼ����Կ���������Ӧ���е�ʱ35-40min�������ʵ������䣬˵����Ӧ�ﵽ�ڶ���ƽ��״̬��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬���Գ�ȥ0.1mol������ʱƽ�ⳣ��K�����䣬�ʴ�Ϊ�������0.1molNH3�����ڡ�


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Ʊ���ЧƯ��NaClO2��ʵ��������ͼ��ʾ����ӦI�з����ķ�ӦΪ3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl������˵������ȷ����

A. ��Ӧ����H2O2����ԭ��
B. ��Ʒ�к���SO42����Cl��
C. NaClO2��Ư��ԭ����SO2��ͬ
D. ʵ���ҽ��нᾧ����ͨ���������н���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(AlP)��һ�ֳ�������ʳ�ִ��Ĺ�����Ѭ��ɱ�������ˮ���������߶�������PH3(�е㣭89.7�棬��ԭ��ǿ)����������ί�涨��ʳ������(��PH3��)�IJ�����������0.05mg/kgʱΪ�����ϸ�֮���ϸ�ij��ѧ��ȤС���ͬѧ�����������ⶨij��ʳ��Ʒ�в���������������ж��Ƿ�ϸ�
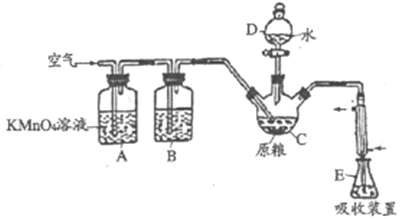
��C�м���100gԭ����E�м���20.00mL2.50��10��4mol/ L KMnO4��Һ(H2SO4�ữ)����C�м�������ˮ����ַ�Ӧ�����������Ʊ���Һ�ζ�E�й�����KMnO4��Һ���ش��������⣺
(1)PH3�ĵ���ʽΪ___________������D��������___________��
(2)ͨ�������������___________��
(3)װ��B��ʢװ����ûʳ����ļ�����Һ�������������տ����е�O2����ȥ����װ�ã���ʵ���Ӱ��Ϊ___________��
(4)װ��E��PH3�����������ᣬ��װ��E�з�����Ӧ�����ӷ���ʽΪ__________���ռ�װ��E�е�����Һ����ˮϡ����250mL��ȡ25.00mL����ƿ�У���4.0��10��5mol/L��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ20.00mL��Na2SO3��KMnO4��Һ��Ӧ�����ӷ���ʽΪ��SO32��+MnO4��+H+��SO42��+Mn2++H2O(δ��ƽ)�����ԭ����Ʒ������(��PH3��)������Ϊ__________mg����ԭ����Ʒ__________(�����ϸ����������ϸ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���о���������������ʱ���ı��ܱ�������ijһ������A2(g)��3B2(g)![]() 2AB3(g) ��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������ж���ȷ����( )
2AB3(g) ��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������ж���ȷ����( )

A. ��T2��n(A2)����ʱ�ﵽƽ�⣬AB3�����ʵ�����С Ϊ��c>b>a
B. ��T2>T1��������Ӧһ���Ƿ��ȷ�Ӧ
C. �ﵽƽ��ʱA2��ת���ʴ�СΪ��b>a>c
D. ��T2>T1���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊvd>vb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,����̼����MCO3��M�ֱ�ΪA��B�������ӣ��ij����ܽ�ƽ��������ͼ��ʾ����֪��pM=lgc(M)��p(CO32)=lgc(CO32)����֪ACO3��BCO3�ܽ�ȸ����������������ӵ�ˮ�⣩������˵����ȷ����

A. ��a��ʾACO3���ܽ�ƽ������
B. ���¶��£���ACO3�ı�����Һ�м���Na2CO3��Һ��һ���ܲ�������
C. ��0.1L 1mol/L��BCl2��Һ�м���Na2CO3���壬������Na2CO3���������Ϊ116.6gʱ��B2+����ǡ�ó�����ȫ��B2+����Ϊ10��5mol/Lʱ��Ϊ������ȫ��
D. ACO3��Ksp=10��4.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��XԪ�ص�1��ԭ��ʧȥ2������ת�Ƶ�YԪ�ص�2��ԭ����ȥ���γ����ӻ�����Z������˵���в���ȷ���ǣ� ��
A. Z���ۻ�״̬�¿��Ե���B. Z���Ա�ʾΪXY2
C. X�γ�+2��������D. Z�д��ڹ��ۼ�,Z���Ե���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ���н���Ԫ�صĻ�����һ�������ӻ�����
B. IA���VIIA��Ԫ��ԭ�ӻ���ʱ��һ���������Ӽ�
C. �ɷǽ���Ԫ���γɵĻ�����һ���������ӻ�����
D. ���ý�������÷ǽ�������ʱ�����γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp��AgCl��=1.56��10-10��Ksp��AgBr��=7.7��10-13��Ksp��Ag2CrO4��=9.0��10-12��ij��Һ�к���Cl-��Br-��CrO42-Ũ�Ⱦ�Ϊ0.010mol.L-1�������Һ����μ���0.010mol.L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ��������
A. Cl-��Br-��CrO42- B. CrO42-��Br-��Cl-
C. Br-��Cl-��CrO42- D. Br-��CrO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)+nB(g)![]() pC(g)���ﵽƽ��������¶�ʱ��B ��ת���ʱ����Сѹǿʱ�������ϵ�� C ����������Ҳ��С����:
pC(g)���ﵽƽ��������¶�ʱ��B ��ת���ʱ����Сѹǿʱ�������ϵ�� C ����������Ҳ��С����:
(1)�÷�Ӧ���淴ӦΪ_________�ȷ�Ӧ����m+n_________p(����������=��������)��
(2)��ѹʱ��A ����������_________��(��������������С����������������ͬ)
(3)������ B(�������)���� B ��ת����_________��
(4)�� B ����ɫ���ʣ�A��C ����ɫ������� C(�������)ʱ�������ɫ_______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com