
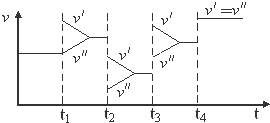
| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
分析 A、增大体系的压强,正逆反应速率立即增大,平衡2SO2(g)+O2(g)?2SO3(g)正向移动,正反应速率大于逆反应速率;
B、减小压强,正逆反应速率立即减小,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,逆反应速率大于正反应速率;
C、升高温度,正逆反应速率迅速增大,逆反应速率大于正反应速率,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动;
D、催化剂只能加快反应速率,但是不改变平衡的移动.
解答 解:A、增大体系的压强,正逆反应速率立即增大,应离开原来的速率点,平衡2SO2(g)+O2(g)?2SO3(g)正向移动,正反应速率大于逆反应速率,故A错误;
B、t2时减小压强,正逆反应速率立即减小,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,此时逆反应速率大于正反应速率,v″大于v′,故B错误;
C、t3时升高温度,正逆反应速率迅速增大,逆反应速率大于正反应速率,平衡2SO2(g)+O2(g)?2SO3(g)逆向移动,v″大于v′,故C错误;
D、催化剂只能加快反应速率,但是不改变平衡的移动,故D正确.
故选D.
点评 本题考查化学反应速率、化学平衡的影响因素,难度不大,注意反应速率的变化以及平衡移动之间的关系.


科目:高中化学 来源: 题型:解答题
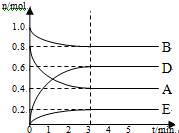 某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.
某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
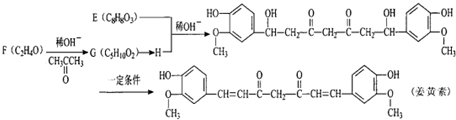
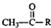 $\stackrel{稀OH-}{→}$
$\stackrel{稀OH-}{→}$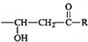
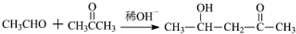 ,G→H的反应类型为氧化反应
,G→H的反应类型为氧化反应 ;将F滴人新制Cu(OH)2悬浊液,加热,观察到的现象是出现红色沉淀
;将F滴人新制Cu(OH)2悬浊液,加热,观察到的现象是出现红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 组 | (A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 | ①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
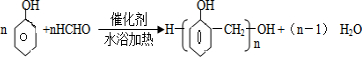 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| B. | 将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应可得到NH3分子数为NA | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com