
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:
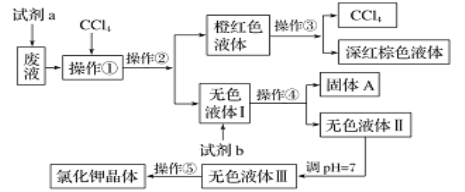
已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题:
(1)若试剂a为H2O2溶液(H+),已知H2O2 + 2KBr + 2HCl = Br2 + 2H2O + 2KCl
①发生反应的离子方程式为:__________;
②每消耗0.2molH2O2,反应转移的电子数为______mol;
③还原剂和还原产物的物质的量之比是_______;
(2)操作①②③④⑤对应的名称分别是:______、分液、_____、过滤、______ ;
(3)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是____、____、____(填化学式);
(4)调pH=7是为了除去杂质离子________和_________,以提高氯化钾晶体的纯度;
(5)操作⑤中用到的瓷质仪器名称是_________ 。
【答案】H2O2 + 2Br- + 2H+ = Br2 + 2H2O 0.4 1:1 萃取 蒸馏 蒸发结晶 BaCl2 KOH K2CO3 OH- CO32- 蒸发皿
【解析】
根据图示可知,制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体;
(1)结合离子方程式的书写原则和氧化还原反应的原理分析;
(2)加入CCl4的目的是萃取;紧接着萃取后的操作是将有机层与水层分开,叫做分液;从含有溴的CCl4溶液中分离得到CCl4和液溴的操作,是将两种相互混溶的液体进行分离的操作,叫做蒸馏;操作④完成后得到固体A和无色液体I,分离固体和液体的操作是过滤;操作⑤是从溶液中得到能溶解于水的氯化钾晶体,是蒸发结晶;
(3)除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液;
(4)无色液体Ⅱ中还含有杂质离子CO32-和OH-;用pH试纸测定至pH=7;
(5)操作⑤是蒸发结晶,由此判断需要的仪器。
制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体,
(1)①反应H2O2 + 2KBr + 2HCl = Br2 + 2H2O + 2KCl中KBr、HCl和KCl均为可溶于水的强电解质,能完全电离,则发生反应的离子方程式为H2O2 + 2Br- + 2H+ = Br2 + 2H2O;
②反应中氧元素的化合价从-1价降为-2价,则每消耗0.2molH2O2,反应转移的电子数为0.2mol×2=0.4mol;
③反应中KBr是还原剂,H2O是还原产物,则还原剂和还原产物的物质的量之比是1:2;
(2)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-;操作①是萃取,操作②是将互不相溶的两种液体分开分液,操作③是将沸点不同、互溶的两液体分开-蒸馏,操作④是将溶液与沉淀分开过滤,操作⑤是将KCl从其水溶液中提取出来-结晶,操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶;
(3)由于除杂时除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液.而且只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可;
(4)由以上知,无色液体Ⅱ中还含有杂质离子CO32-和OH-,需用盐酸来除去过量的KOH及K2CO3,调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7;
(5)由于操作⑤是蒸发结晶,所以该操作用到的瓷质仪器是蒸发皿。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
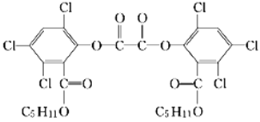
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是( )
①浓硫酸稀释 ②Ba(OH)2·8H2O与固体NH4Cl混合 ③ H2在O2中完全燃烧 ④Al与盐酸反应
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三届联合国环境大会的主题为“迈向零污染地球”。下列做法不应提倡的是( )
A. 推广电动汽车,践行绿色交通 B. 回收电子垃圾,集中填埋处理
C. 水果保鲜,可用浸泡过高锰酸钾溶液的硅土 D. 净化工业尾气,减少雾霾生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是
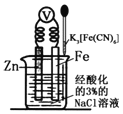
A. 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀
B. 本实验牺牲了金属Fe来保护金属Zn
C. 该装置为电解池
D. 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达到平衡的反应4NH3(g)+6NO(g)5N2(g)+ 6H2O( g) ,减小压强,产生的影响是 ( )
A.正反应速率增大,逆反应速率减小
B.正反应速率减小,逆反应速率增大
C.正、逆反应速率都减小
D.正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①铁能被磁铁吸引
②在人体的血红蛋白中含有铁元素
③镁在空气中可剧烈燃烧,并发出强光
④铁能在氧气中剧烈燃烧,生成黑色的Fe3O4
⑤在空气中加热铜可生成黑色的CuO
A.①②④⑤B.②③④⑤
C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是
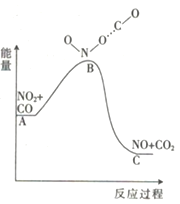
A. 图中A→B的过程为放热过程
B. 该反应为氧化还原反应
C. 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
D. 1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2 )2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备 Ca(NO2 )2,实验装置如图所示(夹持装置已略去)。已知:2NO +CaO2 ═ Ca (NO2)2; 2NO2 +CaO2═Ca(NO3)2。
下列说法不正确的是
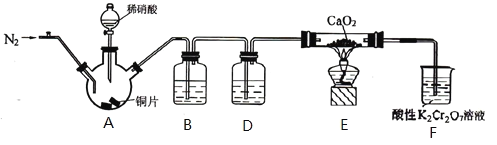
A. 实验开始时,先通一会儿氮气再加入稀硝酸
B. 装置 B、D 中的试剂可分别为水和浓硫酸
C. 装置 F 中酸性 K2Cr2O7 溶液的作用是吸收多余的、未反应的氮氧化物
D. 将铜片换成木炭也可以制备纯净的亚硝酸钙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com