
T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据如下表:
CO2(g)+H2(g),反应过程中测定的部分数据如下表:
|
反应时间/min |
n(CO)/mol |
n(H2O)/mol |
|
0 |
1.20 |
0.60 |
|
10 |
0.80 |
|
|
20 |
|
0.20 |
下列说法正确的是
A.反应在10min内的平均速率为v(H2)=0.04mol · L-1 · min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)= 0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至T2℃(T2>T1)时,上述反应平衡常数为0.64,则正反应为吸热反应
B
【解析】
试题分析:试题分析:根据表中数据可知,t1时CO的物质的量减少了0.2mol,所以生成氢气的物质的量就是0.2mol,则氢气的反应速率是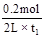 ,A不正确;由于t1>t2,所以平衡时剩余水蒸气是0.2mol,则消耗水蒸气是0.4mol,因此生成CO2是0.4mol。而选项B中温度不变,因此平衡常数不变,则反应前后体积不变,因此平衡时CO2的物质的量仍然是0.4mol,B正确;该反应的平衡常数时
,A不正确;由于t1>t2,所以平衡时剩余水蒸气是0.2mol,则消耗水蒸气是0.4mol,因此生成CO2是0.4mol。而选项B中温度不变,因此平衡常数不变,则反应前后体积不变,因此平衡时CO2的物质的量仍然是0.4mol,B正确;该反应的平衡常数时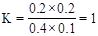 ,则C中设平衡时生成氢气、CO2的浓度都是x,则根据平衡常数表达式可知
,则C中设平衡时生成氢气、CO2的浓度都是x,则根据平衡常数表达式可知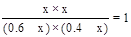 ,解得x=0.24L/mol,所以水蒸气的含量是(0.4-0.24)÷1=16%,而原平衡状态中水蒸气的含量是0.1÷0.9=11.1%,因此选项C错误;升高温度平衡常数减小,所以正反应是放热反应,即升高温度平衡向逆反应方向移动,,因此平衡常数减小,答案选BC。
,解得x=0.24L/mol,所以水蒸气的含量是(0.4-0.24)÷1=16%,而原平衡状态中水蒸气的含量是0.1÷0.9=11.1%,因此选项C错误;升高温度平衡常数减小,所以正反应是放热反应,即升高温度平衡向逆反应方向移动,,因此平衡常数减小,答案选BC。
考点:考查反应速率、平衡常数的有关计算
点评:该题容易漏选C。因为在一般情况下,如果平衡向正反应方向移动,则反应物的含量应该是降低。但由于该题是反应前后体积不变的,所以需要根据平衡常数进行计算才能得出正确的答案,而不能只凭表象,需要具体问题具体分析,灵活运用。


科目:高中化学 来源: 题型:
(14 分)在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催 化剂,发生反应N2(g) + 3H2(g) ![]() 2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。
 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25% b.等于25% c.小于25%
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1 >T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源:2010年石家庄市高中毕业班复习教学质量检测二理科综合能力测试化学试题 题型:填空题
在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催 化剂,发生反应N2(g) + 3H2(g)  2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25% b.等于25% c.小于25%
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1>T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三上学期12月月考化学试卷(解析版) 题型:选择题
T1℃时,向容积为2 L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
|
反应时间/min |
n(A)/mol |
n(B)/ mol |
|
0 |
1.00 |
1.20 |
|
10 |
0.50 |
|
|
30 |
|
0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源:湖北省模拟题 题型:填空题
 2C(g);△H
2C(g);△H 
查看答案和解析>>
科目:高中化学 来源: 题型:
在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催 化剂,发生反应N2(g) + 3H2(g) ![]() 2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。
 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25% b.等于25% c.小于25%
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1 >T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com