
| A.X的单质和Q的单质均可用电解法制得 |
| B.X与Z可形成同时含有极性键和非极性键的化合物 |
| C.Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D.X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:问答题
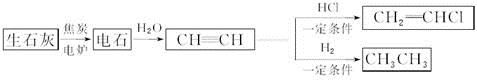
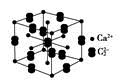
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13C与15N有相同的中子数 |
| B.13C与C60互为同位素 |
| C.15N与14N是N元素的两种同位素 |
| D.15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高熔点的固体如果不是离子晶体,则一定为原子晶体 |
| B.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S |
| C.由两种元素组成的共价化合物分子中,只可能存在极性键 |
| D.若X+ 和Y2-的核外电子层结构相同,则原子序数:X>Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.离子半径:T< W<G |
| B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C.最简单气态氢化物的热稳定性:Q<R |
| D.T和G组成的化合物溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a = b+m+n | B.a = b-m+n | C.a = b+m-n | D.a=b-m-n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com