
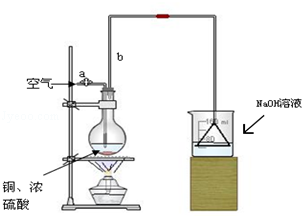
���� ��1���л���������������װ��ʵ��ǰ�������װ�������ԣ�
��2�����������£�Ũ�����Cu��Ӧ���ɶ���������������������������ܺͼӦ���Ҷ��������ж�������ֱ���ſգ�
��3�����������£�Ũ�����Cu��Ӧ��������ͭ�����������ˮ��װ���г������ܼ��������������ã�ʹˮ��������������
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ���������������Ԫ�����ʵ�����������Ԫ���غ��ϻ�ѧ����ʽ������Ҫ��Ӧ���������Ũ�ȣ�
��� �⣺��1��ʵ��װ�����Ʊ�������������ķ���װ�ã���ʵ��ǰ��Ҫ����װ�������ԣ���ֹװ��©��Ӱ��ʵ�飬
�ʴ�Ϊ������װ�������ԣ�
��2��������������Ⱦ�����岻���ŷŵ������У���Ҫ������������Һ���գ����õ��õ�©�������ǽ�������ֱ�������ձ����Ƿ�ֹҺ�嵹����
�ʴ�Ϊ��SO2����������
��3����ƿ����ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��װ���г������ܼ��������������ã�ʹˮ������������������ȷ��������Һ������ֲ�������ã�
�ʴ�Ϊ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ��������������������Ϊ13.98gΪ���ᱵ���������ʵ���=$\frac{13.98g}{233g/mol}$=0.06mol��������Ԫ���غ㣬������������Ϊ0.06mol�����ݻ�ѧ����ʽ��֪��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O����Ӧ���������ʵ���Ϊ0.12mol��ʣ���������ʵ���=18mol/L��0.020L-0.12mol=0.24mol��ʣ����Ҫ�����Ũ��=$\frac{0.24mol}{0.02L}$=12mol/L��
�ʴ�Ϊ�����ˣ�ϴ�ӣ����12mol/L��
���� ������Ũ�����Cu�ķ�ӦΪ���忼������ʵ�鷽����ƣ�Ϊ��Ƶ���㣬�漰�������㡢����������������ԭ��Ӧ��֪ʶ�㣬��ȷʵ��������������������ǽⱾ��ؼ���֪�������������ò�ע��ʵ������淶�ԣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2O��C2H4O2��C6H12O6 | B�� | C6H6O��C5H10��C7H6O2 | ||
| C�� | C2H4��C2H5OH��HOCH2CH2COOH | D�� | H2��CO��CH3OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƶ��γɹ��̣� | B�� | CCl4��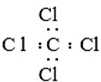 | ||
| C�� | ������N��N�� | D�� | ������̼��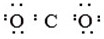 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | C2H6 | C�� | C3H6 | D�� | C3H8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �� | C�� | �� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
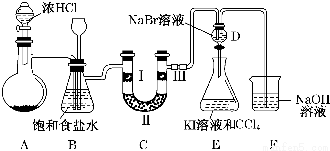
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HNO3��Ba��NO3��2��NH4NO3��AgNO3 | B�� | HNO3��NH4NO3��Ba��NO3��2��AgNO3 | ||
| C�� | NH4NO3��HNO3��Ba��NO3��2��AgNO3 | D�� | NH4NO3��HNO3��AgNO3��Ba��NO3��2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com