
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:| 5 |
| 2 |
| 5 |
| 2 |
| 0.8mol-0.6mol |
| 0.8mol |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、Ca(OH)2═Ca2++OH- | |||||||
| B、KClO3═K++Cl-+3O2- | |||||||
C、Na2CO3═Na2++CO
| |||||||
| D、HCl═H++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸、碱一定含氢,盐一定不含氢 |
| B、酸、碱、盐可能都不含金属元素 |
| C、碱、盐可能含氧,酸一定含氧 |
| D、盐一定含金属元素,酸、碱不一定含金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应SiO2+3C═SiC+2CO中,氧化剂与还原剂的物质的量之比为1:2 |
| B、向蔗糖中加入浓硫酸,蔗糖变黑,并有刺激性气味,说明浓硫酸具有脱水性和强氧化性 |
| C、浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
| D、铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
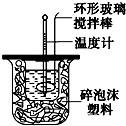 如图装置测定中和热的实验步骤如下:
如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中每一方格表示有关的一种反应物或生成物.已知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其他不含B元素的反应物以及各步反应添加的必要试剂和反应条件均被略去).
图中每一方格表示有关的一种反应物或生成物.已知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其他不含B元素的反应物以及各步反应添加的必要试剂和反应条件均被略去).查看答案和解析>>
科目:高中化学 来源: 题型:
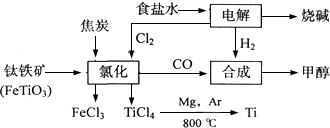
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com