
【题目】一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3三种溶液,应选用
A. BaCl2 B. HCl C. NaOH D. Ba(OH)2
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是_____________,表明SO2吸收效率低的实验现象是B中溶液______________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是______________。(任写一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2),限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,____________ 。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,_______。 | 与白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=______mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能________(填“无影响”、“偏低”或“偏高”);乙同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能________(填“无影响”、“ 偏低”或“偏高”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 中,已知Cu3P 中P为﹣3价,则15mol CuSO4可氧化的P的物质的量为( )
A.1.5 mol
B.5.5 mol
C.3 mol
D.2.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,下列叙述正确的是( )

A. 每生成2分子AB吸收b kJ热量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是( )
A. 减少有毒物 B. 治理污染点 C. 处理废弃物 D. 杜绝污染源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42-
C.PH=7的溶液中:Al3+、Cl-、Na+、NO3-
D.25℃时,水电离出的c(H+)=1×l0l3mol/L的溶液中:K+、Ba2+、NO3、S2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( )
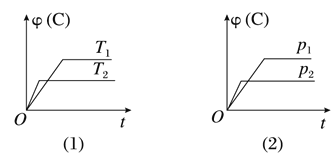
A. 达到平衡后,若使用催化剂,C的体积分数将增大
B. 当平衡后,若温度升高,化学平衡向逆反应方向移动
C. 化学方程式中,n>e+f
D. 达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
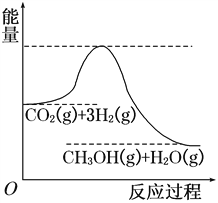
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
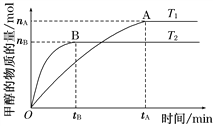
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K= 。
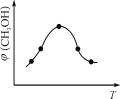
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
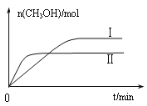
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比![]() =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com