
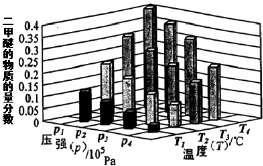
���� ��1������ͼ��֪���¶�һ��ʱ��ƽ��ʱ�����ѵ����ʵ���������P1��P2��P3��P4�����÷�Ӧ����ӦΪ���������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ��������ѵ����ʵ�����������������ʽ���ת���ʵ��ڱ仯���ͳ�ʼ���ı�ֵ�����㣻
��A����Ӧ���Ũ������ƽ�����������Ӧ�����ƶ���
B���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ������������������ݻ�ʼ���Dz���ģ�
C������Ӧ����С���淴Ӧ���ʣ�ƽ��һ�����淴Ӧ�����ƶ���
D��������ת���ʼ�С����ƽ�ⲻһ�����淴Ӧ�����ƶ���
��2��һ���¶��£�̼��������Һ�еĵ��볣��Kֻ���¶ȵ�Ӱ�죬��Һ��ʾ���ԣ�ϡ�ͺ���Լ�����������Һ�еĵ���غ�ȷ������Ũ��֮��Ĵ�С��ϵ��
��3�����ݳ����ܽ�ƽ����Ksp����ʽ���м��㼴�ɣ�
��� �⣺��1������ͬ�¶��£�p1ʱCH3OCH3���ʵ�����������p3ʱCH3OCH3���ʵ������������ݻ�ѧ����ʽ����ѹƽ�������ƶ�������p1��p3��T3ʱCH3OCH3���ʵ�����������T1ʱCH3OCH3���ʵ�����������Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ�������T1��T3������K1��K3�����ݡ�����ʽ�����м��㣬�����ɵ�CH3OCH3�����ʵ���Ϊx����
2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g��
��ʼ���ʵ�����mol�� 2 6 0 0
ת�����ʵ�����mol�� 2x 6x x 3x
ƽ�����ʵ�����mol�� 2-2x 6-6x x 3x
��$\frac{x}{8-4x}$=0.1�����x=0.5714��H2��ƽ��ת����=$\frac{6x}{6}$��100%=57.14%���ʴ�Ϊ����������57.14%��
��A����Ӧ���Ũ������ƽ�����������Ӧ�����ƶ�������С���������A����
B���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ������������������ݻ�ʼ���Dz���ģ���˻��������ܶ�ʼ�ղ��䣬B����
C������Ӧ����С���淴Ӧ���ʣ�ƽ��һ�����淴Ӧ�����ƶ���C��ȷ��
D��������ת���ʼ�С����ƽ�ⲻһ�����淴Ӧ�����ƶ�������ͨ��������������ת����Ҳ�ϵͣ�D����
��ѡC��
��2��һ���¶��£�̼��������Һ�еĵ��볣��K������Ϊϡ�Ͷ��ı䣬��ϡ��������Һ�ļ��Լ�����c��H+�����ʱ�ֵ��С����ΪNa2CO3��NaHCO3��Һ�ʼ��ԣ����Ե��ܶɳ�����ʱ��CO2��������Һ������ΪNaHCO3��H2CO3������c��HCO3?����c��CO32?�������ݵ���غ�ɵ�2c��CO32?��+c��HCO3?��=c��Na+��=0.2 mo1/L��
�ʴ�Ϊ����С������0.2��
��3���������ɳ�������CaCl2��Һ����СŨ��Ϊx��������Һ��������ʱ�������ʵ�Ũ�ȶ���Сһ�룬���� $\frac{x}{2}$����2��10-4mo1/L��$\frac{1}{2}$=2.8��10-9��x=5.6��10-5mol/L��
�ʴ�Ϊ��5.6��10-5��
���� �����ۺϿ���ѧ���йػ�ѧƽ��ļ��㡢ƽ��״̬���жϡ���ѧƽ���ƶ�ԭ����֪ʶ�������ۺ�֪ʶ�Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S2-�Ľṹʾ��ͼ��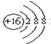 | B�� | �����ĵ���ʽ��Cl��Cl | ||
| C�� | ��-18��ԭ�ӷ��ţ�${\;}_{8}^{18}$O | D�� | CO2���ӵĽṹʽ��O=C=O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.22 mol•��L•min��-1 | B�� | 0.1 mol•��L•min��-1 | ||
| C�� | 0.04 mol•��L•min��-1 | D�� | 0.08 mol•��L•min��-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʳ������ʳ�� | B�� | �������ȥ������������� | ||
| C�� | ��Һ��������� | D�� | ��Ư�۾�������Ӿ���е�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
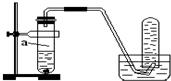 ��������a��b����п���У��ֱ���������ҵ�����ϡH2SO4��ͬʱ��a�м���������CuSO4��Һ����ͼ��ʾ����H2�������V����ʱ�䣨t���Ĺ�ϵ��������ȷ���ǣ�������
��������a��b����п���У��ֱ���������ҵ�����ϡH2SO4��ͬʱ��a�м���������CuSO4��Һ����ͼ��ʾ����H2�������V����ʱ�䣨t���Ĺ�ϵ��������ȷ���ǣ�������| A�� | 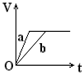 | B�� | 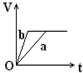 | C�� | 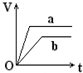 | D�� | 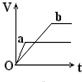 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
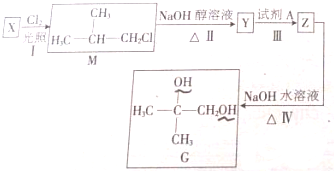

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯī������ʯ�ȶ� | |
| B�� | ���ʯ��ʯī��Ϊͬλ�� | |
| C�� | ʯī�������ڽ��ʯ | |
| D�� | �������Ľ��ʯ��ʯī��ȫȼ�գ�ʯī�ų��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ԣ�A��=0.20mol/��L•min�� | B�� | �ԣ�B��=0.45 mol/��L•min�� | ||
| C�� | �ԣ�C��=0.30 mol/��L•min�� | D�� | �ԣ�D��=0.35 mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������֧�Թܵ���ɫ������ͬ | |
| B�� | A�Թ���Fe��OH��3������� | |
| C�� | ֱ�Ӽ�������Fe2��SO4��3��Һ�ɵõ�Fe2��SO4��3���� | |
| D�� | B�Թ���Fe2��SO4��3���ܷ���ˮ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com