
| A. | X、Y的转化率相等 | |
| B. | 在恒温恒压条件下,达到平衡后充入Y气体,则平衡正向移动 | |
| C. | 平衡时,Y和Z的生成速率之比为2:3 | |
| D. | c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X、Y的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X(g)+3Y(g)?2Z(g),
开始(mol/L):c1 c2 c3
变化(mol/L):0.04 0.12 0.08
平衡(mol/L):0.1 0.3 0.08
c1=0.14 c2=0.42 c3=0
若反应逆正反应进行到达平衡,X、Y的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X(气)+3Y(气)?2Z(气),
开始(mol/L):c1 c2 c3
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.1 0.3 0.08
c1=0 c2=0 c3=0.28
由于为可逆反应,物质不能完全转化所以起始时浓度范围为0<c(X)<0.14,0<c(Y)<0.42,0<c(Z)<0.28,
A、X、Y的变化量之比和起始量之比相同,所以转化率相同,故A正确;
B、在恒温恒压条件下,达到平衡后等比例充入X和Y气体平衡不移动,现仅充入Y气体,则平衡逆向移动,故B错误;
C、平衡时,Y和Z的生成速率之比为化学方程式系数之比为3:2,故C错误;
D、依据上述计算,c1的取值范围为0<c1<0.14mol•L-1,故D错误;
故选A.
点评 本题考查了化学平衡的建立可以逆向进行,也可以正向进行,依据极值法进行转化计算分析判断是本题的关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
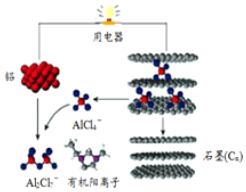 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )| A. | 该电池充电时的电子流向为:铝→用电器→石墨(C) | |
| B. | 该电池放电时石墨电极发生氧化反应 | |
| C. | 充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 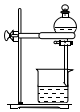 用于分离酒精和水 | |
| B. | 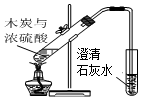 用于验证木炭与浓硫酸的反应产物中含有CO2 | |
| C. | 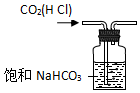 用于除去CO2中的少量HCl | |
| D. | 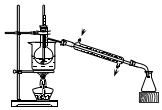 用于制备蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与酸性KMnO4溶液的反应:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| B. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是① | |
| C. | 若分别加入25mL 0.1mol•L-1盐酸后,pH最小的是② | |
| D. | 若升高温度,则③的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔现象区分溶液与胶体 | |
| B. | 用蒸馏的方法除去自来水中含有的Cl- | |
| C. | 用萃取的方法从某些植物中提取香料或中药成份 | |
| D. | 金属钠长期暴露在空气中的最终产物是NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以加快反应速率 | |
| B. | 增大压强可以加快反应速率 | |
| C. | 反应达到平衡时,v(正)=v(逆) | |
| D. | 增大O2的量可以使NH3100%转变为NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com