
(1)课本上叙述:“……碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的.”据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”下同)________性,铅的+4价化合物应具有较强的________性.PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为________.
(2)我国古代炼丹中经常使用到红丹,俗称铅丹.在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3![]() PbO2+2Pb(NO3)2+2H2O.
PbO2+2Pb(NO3)2+2H2O.
铅丹的化学式是________,此铅丹中铅的化合价是________.
由此反应可推测PbO是(填“酸”或“碱”,下同)________性氧化物,PbO2是________性氧化物.
(3)砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是________上述反应中电子转移数目是________.
科目:高中化学 来源: 题型:阅读理解
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:022
(1)课本上叙述:“……碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的.”据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”下同)________性,铅的+4价化合物应具有较强的________性.PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为________.
(2)我国古代炼丹中经常使用到红丹,俗称铅丹.在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3![]() PbO2+2Pb(NO3)2+2H2O.
PbO2+2Pb(NO3)2+2H2O.
铅丹的化学式是________,此铅丹中铅的化合价是________.
由此反应可推测PbO是(填“酸”或“碱”,下同)________性氧化物,PbO2是________性氧化物.
(3)砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是________上述反应中电子转移数目是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应进程 酸 | 1 min | 2 min | 5 min | 15 min | 20 min |
3 mol·L-1HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
1.5 mol·L-1H2SO4 | 均无明显现象(无气泡) | ||||
3 mol·L-1H2SO4 | 均无明显现象(无气泡) | ||||
无论是用1.5 mol·L-1还是用3 mol·L-1的稀硫酸,均无明显现象。其结论还是与教材的叙述不相符合。
(1)为了探究“铝跟稀盐酸、稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设(或猜想)?
假设一:______________________________________________________________。
假设二:______________________________________________________________。
……
(2)为了论证上述假设,你设计的实验方案是:(探究过程)
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二第二次月考理科综合试题(化学部分) 题型:填空题
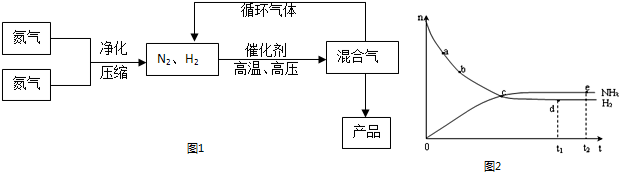
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:

|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是

A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com