
(1)配平下列离子反应方程式:
________Fe(OH)3+________ClO-+________OH-![]() ________FeO4n-+________Cl-+________H2O
________FeO4n-+________Cl-+________H2O
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.4×1022个电子,则n=________,FeO4n-中铁元素的化合价为________.
(3)根据(1)、(2)推测,FeO4n-能和下列________(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| O | - 3 |
| O | 2- 8 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4CuI+Hg![]() Cu2HgI4+2Cu
Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂是__________,当有1 mol CuI参与反应时,转移电子________mol。
(3)CuI可由Cu2+和I-直接反应制得,配平下列离子反应方程式:□Cu2++□I-![]() □CuI+□
□CuI+□![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3+ClO-+OH-——![]() +Cl-+H2O
+Cl-+H2O
(2)已知有1.07 g Fe(OH)3参加反应时,共转移了1.81×1022个电子,则n=__________,![]() 中铁的化合价为_________。
中铁的化合价为_________。
(3)根据(1)(2)推测,![]() 能和下列________(只填序号)物质发生反应。
能和下列________(只填序号)物质发生反应。
A.KMnO4 B.SO2 C.H2S D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +______,
+______,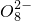 +H2O→Mn
+H2O→Mn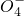 +S
+S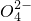 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com