
分析 (1)液面上有大量白雾,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于稀HNO3的凝乳状白色沉淀产生,说明白雾为盐酸的小液滴,即会产生HCl,同时有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色说明是SO2,2.38g SOCl2与水发生上述反应,物质的量=$\frac{2.38g}{119g/mol}$=0.02mol,测得放出热量为17.88kJ,1molSOCl2与水发生上述反应放热894KJ,结合热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)低温蒸干AlCl3溶液,氯化铝水解生成氢氧化铝和盐酸,蒸发过程中HCl挥发,促进水解正向进行得到固体的主要成分是水解产物氢氧化铝,用SOCl2与AlCl3•6H2O混合共热,可得无水AlCl3,是因SOCl2与水反应既减少可水的量,生成的HCl又抑制了AlCl3的水解;
(3)TiCl4在加热的条件下遇水水解可得TiO2•xH2O,同时生成HCl气体,根据水解原理和原子守恒书写;
(4)金属铁是负极,发生电极反应:Fe-2e-=Fe2+,滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀;
解答 解:(1)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,该两种气体应该为氯化氢和二氧化硫,反应的方程式为SOCl2+H2O=2HCl↑+SO2↑,2.38g SOCl2与水发生上述反应,物质的量=$\frac{2.38g}{119g/mol}$=0.02mol,测得放出热量为17.88kJ,1molSOCl2与水发生上述反应放热894KJ,反应的热化学方程式为:SOCl2(l)+H2O(l)═SO2(g)+2HCl(g)△H=-894 kJ/mol,
故答案为:SOCl2(l)+H2O(l)═SO2(g)+2HCl(g)△H=-894 kJ/mol;
(2)低温蒸干AlCl3溶液,氯化铝水解生成氢氧化铝和盐酸,AlCl3+3H2O?Al(OH)3+3HCl,蒸发过程中HCl挥发,促进水解正向进行得到固体的主要成分是水解产物氢氧化铝,低温蒸干AlCl3溶液得到固体的主要成分,SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用;反应的化学方程式为:SOCl2+H2O=2HCl↑+SO2↑,蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3•6H20混合并加热,可得到无水AlCl3,SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用,
故答案为:Al(OH)3,AlCl3溶液易发生水解,AlCl3•6H2O与SOCl2混合后共热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体;
(3)在加热的条件下,TiCl4水解得TiO2•xH2O和HCl,反应方程式为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl↑,
故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl↑;
(4)使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,金属铁是负极,发生电极反应:Fe-2e-=Fe2+;滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀,
故答案为:生成带有特征蓝色的铁氰化亚铁沉淀;
点评 本题考查了元素化合物的性质、热化学方程式书写、离子检验的反应现象、盐类水解及其影响因素为高频考点,侧重于学生的分析能力的考查,题目难度中等,能正确判断SOCl2和水反应的生成物是解本题的关键.


科目:高中化学 来源: 题型:选择题
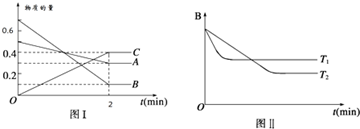
| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | 图(I)中,达平衡时,A的体积分数为37.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
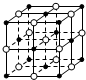
| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硝酸银溶液区分碳酸钠和氯化钠 | |
| B. | 用硝酸钡溶液区分碳酸钠和硫酸钠 | |
| C. | 用氯化钙溶液区分碳酸钠和碳酸氢钠 | |
| D. | 用盐酸区分氢氧化钠和氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-11mol/L | B. | 1×10-3mol/L | C. | 1×10-7mol/L | D. | 0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,Na2CO3 的溶解度小于NaHCO3 的溶解度 | |
| B. | 除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法 | |
| C. | 与同浓度稀盐酸反应,NaHCO3放出气泡的速率更快 | |
| D. | 将二者配成溶液,再分别滴加Ca(OH)2溶液,无白色沉淀生成的是NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与Cl2、盐酸均能发生反应生成FeCl3 | |
| B. | 加热蒸干并灼烧铁、铝的氯化物溶液,最后均得到金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时消耗氯气一样多 | |
| D. | 常温下铁片、铝片与浓硫酸不能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10O2,一定能与金属钠反应放出气体 | |
| B. | 甲苯分子中所有原子可能共面 | |
| C. | 生物柴油在NaOH溶液水解可得一种羧酸盐 | |
| D. | 乙醇、甲苯、葡萄糖能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com