
分析 周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子,则Q为H元素;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布式为1s22s22p2,故R为C元素;X基态原子s能级的总电子数比p能级的总电子数多1,原子核外电子数排布式为1s22s22p3,故X为N元素;Y原子的核外成对电子数是未成对电子数的3倍,原子核外电子数排布式为1s22s22p4,故Y为O元素;Z原子的价电子排布为3d74S2,则Z为Co.
解答 解:周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子,则Q为H元素;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布式为1s22s22p2,故R为C元素;X基态原子s能级的总电子数比p能级的总电子数多1,原子核外电子数排布式为1s22s22p3,故X为N元素;Y原子的核外成对电子数是未成对电子数的3倍,原子核外电子数排布式为1s22s22p4,故Y为O元素;Z原子的价电子排布为3d74S2,则Z为Co.
(1)同周期随原子序数增大元素第一电离能呈增大趋势,N元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能为N>O>C,
Y原子的核外成对电子数是未成对电子数的3倍,原子核外电子数排布式为1s22s22p4,
故答案为:N;1s22s22p4;
(2)H、C元素形成的某分子中共有14个电子,该分子为C2H2,分子中C原子杂化轨道数目为2,碳原子采取sp杂化,该分子的立体构型为直线形,
故答案为:sp;直线形;
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,符合分子晶体具有的性质,据此可判断Fe (CO)5晶体属于分子晶体,CO与N2互为等电子体,与CO互为等电子体的离子有 CN-等,
故答案为:分子晶体;CN-等;
(4)向含Co2+的溶液中加入过量的氨水,并通入适量的O2气体,生成有[Co(NH3)6]3+离子,根据电荷守恒可知有OH-生成,则该反应的离子方程式为:4Co2++24NH3.H2O+O2=4[Co(NH3)6]3++4OH-+22H2O,
故答案为:4Co2++24NH3.H2O+O2=4[Co(NH3)6]3++4OH-+22H2O.
点评 本题是对物质结构与性质的考查,关键根据核外电子排布规律推断元素,注意同周期主族元素第一电离能异常情况,侧重考查学生对知识迁移运用.


科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然橡胶的主要成分是异戊二烯 | |
| B. | 通过物理变化将煤气化和液化,能高效清洁地用煤 | |
| C. | 苯酚能用于环境消毒 | |
| D. | 乙醇是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
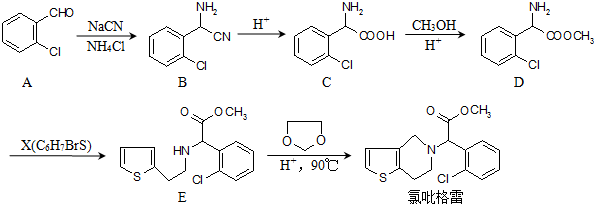
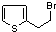 .
. .
.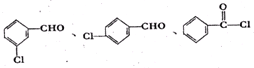 .
.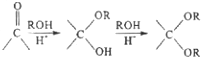
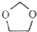 的合成路线图(无机试剂任选)
的合成路线图(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
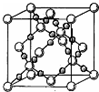 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
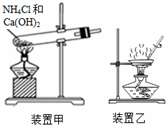
| A. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用装置甲制备氨气 | |
| D. | 用装置乙加热分解Al(OH)3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com