
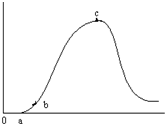
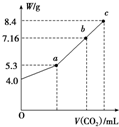
 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:分析 由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
解答 解:(1)曲线由0→a段不产生氢气是因氧化铝与硫酸反应生成硫酸铝和水,发生Al2O3+6H+=2Al3++3H2O,
故答案为:氧化铝与硫酸反应生成硫酸铝和水;
(2)曲线由a→b段产生氢气的速率较慢是因开始时温度较低,反应速率较慢,
故答案为:开始时温度较低;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:该反应为放热反应;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:氢离子浓度减小;
(5)铝与稀硫酸发生2Al+3H2SO4=Al2(SO4)3+3H2↑,离子方程式为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑.
点评 本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同体积的CO和CO2 | B. | 同温同压下,1L CO和1L CO2 | ||
| C. | 常温常压下,1g CO和1g N2 | D. | 在0℃时,同压下等体积的CO2和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
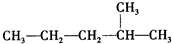 :2-甲基戊烷;CH2=CHCH2CH3:1-丁烯;
:2-甲基戊烷;CH2=CHCH2CH3:1-丁烯;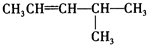 :4-甲基-2-戊烯;
:4-甲基-2-戊烯; 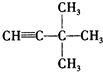 :3,3-二甲基-1-丁炔;
:3,3-二甲基-1-丁炔;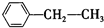 :乙苯;
:乙苯;| 2,3-二甲基丁烷 | 3,4,4-三甲基-1-戊炔 | 3,5-二甲基-2-己烯 |
| CH3CH(CH3)CH(CH3)CH3 | CH≡C-CH(CH3)C(CH3)2CH3 | CH3CH=C(CH3)CH2CH(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s12p1 | B. | 1s22s22p63s23p64s1 | ||
| C. | 1s22s22p33s1 | D. | 1s22s22p63s13p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
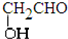 ③CH3CH2CH2CH3和
③CH3CH2CH2CH3和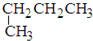
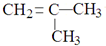 ⑥
⑥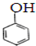 和
和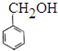
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法 | |
| B. | 明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液 | |
| D. | 工业上合成氨采用500℃左右的温度,其原因是适当加快NH3的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.
钠有多种化合物,如氧化钠、过氧化钠、氢氧化钠、碳酸钠、碳酸氢钠,这些物质在实际生活中有广泛的应用,在一定条件下相互间能进行转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 39g K 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 含4 molHCl的浓盐酸和足量MnO2加热反应可生成NA个Cl2分子 | |
| C. | 标准状况下,22.4L 氟化氢中含2NA个原子 | |
| D. | 2mol单质Cu与足量高温硫蒸气完全反应,失去2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com