
| A. | 0.1g | B. | >0.1g | C. | <0.1g | D. | 无法确定 |
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
→
 ,其核磁共振氢谱有2种峰.
,其核磁共振氢谱有2种峰. ,
,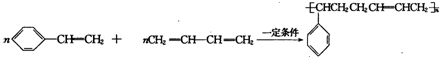 .
. (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3是氧化剂 | B. | N2被氧化 | ||
| C. | AlN的摩尔质量为41 g | D. | 生成1 mol AlN转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
 +H2O→R-COOH+HX
+H2O→R-COOH+HX
 、
、 ;
;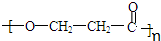 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com