
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
| A. | α1+α2=1;φ2=φ1 | B. | φ3=2φ1;Q3=2Q1 | C. | φ3=φ1=φ2;Q3=2Q1 | D. | α1=α3;Q1+Q2=Q |
分析 因为该反应A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0),为气体体积不变的放热反应,增大压强,平衡不移动,所以在某恒温恒容密闭容器中只要转化到一边满足成比例,则为等效平衡,以此解答该题.
解答 解:因为该反应A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0),为气体体积不变的放热反应,所以在某恒温恒容密闭容器中只要转化到一边满足成比例,则为等效平衡,又
A(g)+B(g)?2C(g)
(1)1 1 0
(2)0 0 2
等效于1 1 0
(3)2 2 0
所以(1)(2)完全等效,(3)是(1)的2倍,成比例等效,则α1=α3,α1+α2=1,φ3=φ1=φ2,Q1+Q2=Q,Q3=2Q1,
故选B.
点评 本题主要考查的是化学平衡中的等效平衡问题,为高频考点,侧重考查学生的分析能力,等效平衡为在一定条件下(恒温恒容或恒温恒压),对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同,做题时注意思路的转化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3分子数为0.1 NA | |
| B. | 标准状况下,2.24 L的CCl4中含有的C-Cl键数为0.4 NA | |
| C. | 常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| D. | 常温常压下,Na2O2与足量CO2反应生成2.24 L O2,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Cl2中少量HC1气体:通过饱和食盐水后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去Fe(OH)3胶体中溶有的少量NaCl:加入适量水后过滤 | |
| D. | 除去CuCl2溶液中少量的FeCl3:加入稍过量的CuO后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 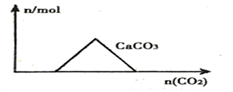 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 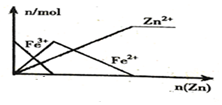 向FeCl3溶液中加入锌粉 | |
| C. | 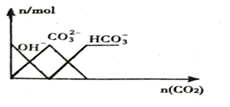 向NaOH溶液中通入CO2 | |
| D. | 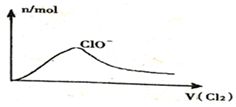 Cl2通入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
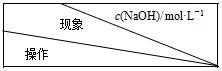 | 5.0 | 6.0 | 7.0 |
| 实验Ⅰ:滴入几滴KSCN溶液 | 不变红 | 不变红 | 不变红 |
| 实验Ⅱ:先加入过量稀硫酸,再滴入几滴KSCN溶液 | 不变红 | 变红 | 变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
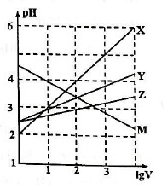 常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )
常温下取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时可能有如下的曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下PH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol•L-1的NaA和HA的混合溶液的PH>7,则c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com