
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)⇌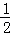 N2(g)+CO2(g)△H=﹣373.2kJ•mol﹣1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=﹣373.2kJ•mol﹣1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
|
| A. | 加催化剂同时升高温度 | B. | 加催化剂同时增大压强 |
|
| C. | 升高温度同时充入N2 | D. | 降低温度同时减小压强 |
考点:
化学反应速率的影响因素;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
达到平衡后,为提高该反应的速率和NO的转化率,则加快反应速率使平衡正向移动,以此来解答.
解答:
解:A.催化剂不改变平衡状态,升高温度平衡逆向移动,NO的转化率减小,故A错误;
B.催化剂不改变平衡状态,增大压强,平衡正向移动,NO的转化率增大,且反应速率加快,故B正确;
C.升高温度平衡逆向移动,NO的转化率减小,充入N2平衡逆向移动,NO的转化率减小,故C错误;
D.降低温度同时减小压强,反应速率均减小,故D错误;
故选:B.
点评:
本题考查影响化学反应速率的因素,注意把握浓度、催化剂、温度、压强对反应速率的影响和平衡移动即可解答,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的五中元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是()
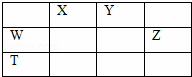
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2,W3X4,WZ4均有熔点高,硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
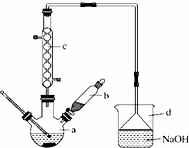
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如下:
苯 溴 溴苯
密度/g•cm﹣3 0.88 3.10 1.50
沸点/℃ 80 59 156
水中溶解度 微溶 微溶 微溶
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体.继续滴加至液溴滴完.装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是 ;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 .(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述中正确的是( )
|
| A. | 难溶于水的电解质一定是弱电解质 |
|
| B. | 强电解质在水溶液中的电离过程是不可逆的 |
|
| C. | 易溶于水的电解质一定是强电解质 |
|
| D. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率与平衡的因素有多方面,如浓度压强温度催化剂等.下列有关说法不正确的是( )
|
| A. | 其它条件不变时,改变压强能改变气体反应的速率,但不一定改变平衡 |
|
| B. | 增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
|
| C. | 温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
|
| D. | 加入催化剂能降低反应所需的活化能,使反应速率加快,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-硫酸和磷酸的摩尔质量相等
-B.-摩尔质量越大,物质的质量越大
-C.-HNO3的摩尔质量是63g
-D.-摩尔质量就等于该物质的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.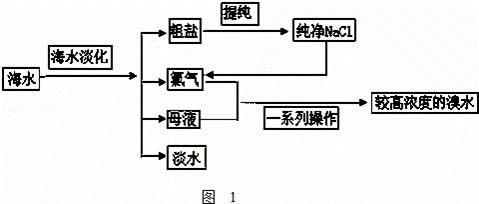
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质.如图2是粗盐提纯的操作流程.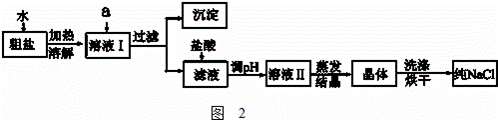
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液.
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、 ;
某同学欲四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的操作: .②分离碘的四氯化碳溶液的操作方法是:
(3)工业上将较高浓度的溴水经进一步处理得到工业溴.某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性.水的沸点为100℃.他们参观生产过程后,设计了如图3装置简图: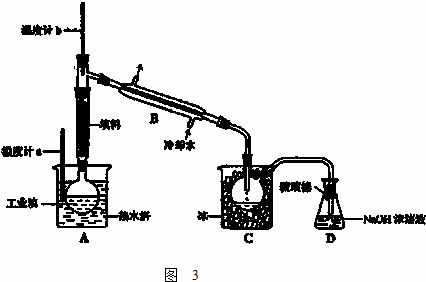
①图中仪器B的名称: .
②用热水浴加热的优点是: .
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 0.012kg 12C含有的12C是NA个 |
|
| B. | NA个水分子的质量是18g/mol |
|
| C. | 1mol O2中含有的氧气分子数为NA个 |
|
| D. | 含有NA个氧原子的H2SO4的物质的量是0.25mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com