
| A.漂白粉长时间露置空气中会结块变质 |
| B.把NaHSO4溶液加入NaAlO2中生成白色沉淀然后沉淀又溶解 |
| C.装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成 |
| D.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生 |


科目:高中化学 来源:不详 题型:单选题
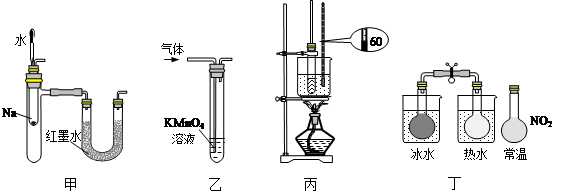
| A.装置甲:验证Na和水反应放热 |
| B.装置乙:除去乙烯中混有的乙炔 |
| C.装置丙:用于实验室制硝基苯 |
| D.装置丁:说明反应2NO2(g) ? N2O4(g)是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
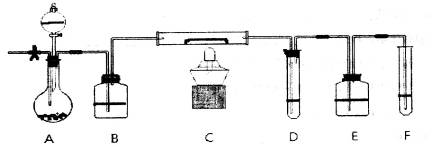
 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物 |
| B.将5.85gNaCl固体溶于1000mL容量瓶中,加水定容后即可制得0.1mol?L-1的NaCl溶液 |
| C.向含有少量Ca(OH)2的Mg(OH)2悬浊液中加入饱和MgCl2溶液,充分搅拌后过滤,洗涤,可达到除去Mg(OH)2中的少量Ca(OH)2的目的 |
| D.精炼铜时,粗铜做阴极,纯铜做阳极,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实 验 | 现象或结论 |
| A | 取少量某溶液,滴加过量的稀盐酸无明显现象,再滴加BaCl2溶液 | 出现白色沉淀,则该溶液中含有SO42- |
| B | 相同温度下,取两份等质量的锌粒分别与足量稀酸反应,向其中一份中加入几滴CuSO4溶液 | 加入ZnSO4溶液的产生氢气快,最终二者生成氢气的量相同 |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向Na2S溶液中滴入ZnSO4溶液有白色沉淀生成,再加入几滴ZnSO4溶液 | 沉淀由白色转化为黑色,说明溶度积(Ksp):ZnS>CuS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去乙烷中混有的乙烯,得到纯净的乙烷 |
| C.用图2装置能验证HC1气体在水中的溶解性 |
| D.用25mL碱式滴定管量取20.00 mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖 |
| B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量。 |
| C.制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分 |
| D.在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O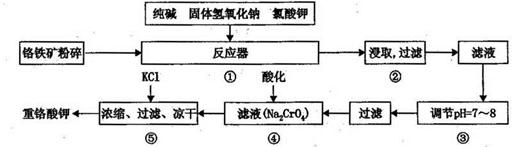
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
| B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C.测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量, |
| D.做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com