
下列有关说法错误的是()
A. 通过化学反应无法生成新的同位素
B. 若化学平衡向正反应方向移动,则正反应速率一定增大
C. 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物
D. 生成盐 和水的反应不一定是中和反应
和水的反应不一定是中和反应
考点: 化学平衡移动原理;同位素及其应用;混合物和纯净物.
专题: 物质的分类专题;化学平衡专题.
分析: A.通过化学反应能生成新的分子不能生成新的原子;
B.若化学平衡向正反应方向移动,但正反应速率不一定增大;
C.由两种或两种以上物质组成的是混合物;
D.生成盐和水的反应不一定是中和反应.
解答: 解:A.通过化学反应不能生成新的原子,所以不能生成新的同位素,故A正确;
B.如果正反应是放热反应,降低温度平衡向正反应方向移动,但正反应速率降低,故B错误;
C.盐酸、氢氧化铁胶体、汽油、橡胶的成分不是一种物质,所以是混合物,故C正确;
D.酸性氧化物和碱反应或碱性氧化物和酸反应都生成盐和水,但都不是酸碱中和反应,故D正确;
故选B.
点评: 本题考查基本概念和基本理论,明确基本概念是解本题关键,难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.22.4L的N2和CO所含分子数均为NA
B.1.7g NH3中含有的电子数为NA
C.标准状况下,11.2L H2O含有的分子数为0.5NA
D.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | P4和CO2分子中都只含有共价键 |
|
| B. | CCl4和NH3的分子的立体结构都是正四面体形 |
|
| C. | BF3分子中各原子均达到8e﹣稳定结构 |
|
| D. | 甲烷的结构式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 原子晶体中只存在非极性共价键 |
|
| B. | 干冰升华时,分子内共价键会发生断裂 |
|
| C. | 稀有气体形成的晶体属于分子晶体 |
|
| D. | 金属元素和非金属元素形成的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析以下说法:上述说法正确的是()
①粗盐和酸雨都是混合物;
②荔枝酿酒和空气液化制取氮气的过程中都只发生物理变化;
③冰和干冰既是纯净物又是电解质;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
A. ①②④ B. ①④⑦ C. ③⑤⑥ D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置处理含NO3﹣的酸性工业废水,某电极反应式为2NO3﹣+12H++10e﹣=N2+6H2O,则下列说法错误的()

A. 电源正极为A,电解过程中有气体放出
B. 电解时H+从质子交换膜左侧向右侧移动
C. 电解过程中,右侧电解液pH保持不变
D. 电解池一侧生成5.6g N2,另一侧溶液质量减少l8g
查看答案和解析>>
科目:高中化学 来源: 题型:
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣90kJ•mol﹣1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=﹣41kJ•mol﹣1
写出由二氧化碳、氢气制备甲醇的热化学方程式: .
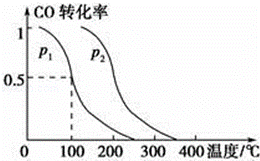
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示.
①p1 小于p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”,下同),平衡常数 .
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol•L﹣1,c始(H2O)=1mol•L﹣1,某时刻经测定CO的转化率为10%,则该反应没有(填“已经”或“没有”)达到平衡,原因是Qc K,此时刻v正 v逆(填“>”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
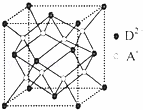
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B﹣少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2﹣离子数之比为2:1.请回答下列问题:
(1)A元素形成的晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为 .
(2)C3﹣的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是杂化,CB3分子的VSEPR模型为 .
(3)C的氢化物在水中的溶解度如何
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是 ρg•cm﹣3.试计算R晶体中A+和D2﹣最短的距离 .(阿伏加德罗常数用NA表示,只写出计算式,不用计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com