
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
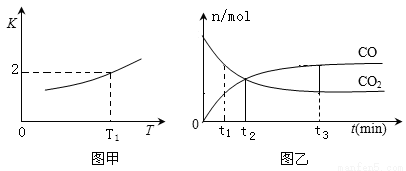
①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | 同种物质的体积分数相同 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 | |
起始时乙容器中的压强是甲容器的____倍。
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:实验题
某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过程如下图所示:
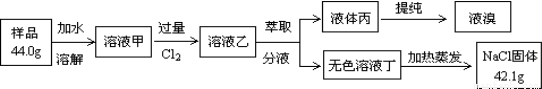
阅读上述实验过程,完成下列填空:
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格A、B、D下填写装置中所放的化学药品。
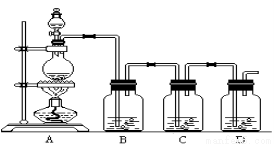
A | → | B | → | C | → | D |
溶液甲 |
(2)萃取所需要的主要玻璃仪器是_______________;
(3)溶液甲中通入Cl2的化学方程式为 ;
(4)原固体样品中氯化钠的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.铝热剂焊接钢轨 B.黏土烧结制陶瓷
C.氢氟酸刻蚀玻璃 D.甘油作护肤保湿剂
查看答案和解析>>
科目:高中化学 来源:2016届浙江省金丽衢十二校高三上学期第一次联考化学试卷(解析版) 题型:填空题
Ⅰ.请回答:
(1)燃着的钠不能用CO2灭火,其理由 (用化学方程式表示)。
(2)完成以下氧化还原反应的离子方程式:
( )Fe3++( )ClO-+______=( )FeO42-+( )Cl-+( )H2O
(3)剧毒物氰化钠的电子式为 ,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
II.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
A(s)+H2(g)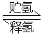 B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色。
(1)A的化学式为 ,LiH中r(Li+) r(H-)(填“大于”或“小于”)。
(2)写出液氨与金属锂反应的化学方程式 。
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为 。
(4)化合物E也可以作储氢材料,其储氢原理可表示为:
E(s)+H2(g) A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
储氢材料可以通过加热的方式释放氢气。从实用化角度考虑,选择 (填“A”或“E”)作储氢材料更合理,理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:选择题
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实脸现象的解释不正确的是
A.铝在空气中能很快形成氧化膜 B.用酸处理时未能将氧化膜溶解
C.氧化铝的熔点比铝高 D.氧化铝薄膜包住了熔化的铝
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:计算题
将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。
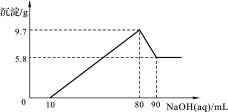
(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:计算题
碳酸氢钠受热易分解为碳酸钠。现加热5.00 g 碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,求①生成CO2多少L(标准状况)? ②原混合物中碳酸钠的质量分数是多少?
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

Ⅰ.(1)X位于元素周期表中的位置______________;W的基态原子核外有_________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 ____________。
Ⅱ.部分化学键的键能见下表:
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“”“”)SiC________Si;SiCl4________SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),
Si(s)+4HCl(g),
计算该反应的反应热△H=_________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期12月月考化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3。下列叙述正确的是
A.该溶液中:c2(H+)≠c(H+)·c(A-)+Kw
B.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中:
2c(H+)+c(HA)===c(A-)+2c(OH-)
C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:
c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
D.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:
c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com