

| A. | a和b不连接时,铁片上会有金属铜析出,从而使铁的腐蚀速率加快 | |
| B. | a和b用导线连接时,铜片上发生的反应为Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极,能实现铁上镀铜,并使Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解 |
分析 A.a和b不连接时,发生置换反应;
B.a和b用导线连接时,Cu为正极,在正极上阳离子得电子;
C.a和b分别连接足够电压的直流电源正、负极时,形成电解池,b为阴极,阳离子向阴极移动;
D.无论a和b是否用导线连接,均发生Fe+Cu2+=Cu+Fe2+.
解答 解:A.a和b不连接时,铁片上发生Fe+Cu2+=Cu+Fe2+置换反应,则铁片上会有金属铜析出,故A正确;
B.a和b用导线连接时,Cu为正极,在正极上阳离子得电子,则发生Cu2++2e-=Cu,故B正确;
C.a和b分别连接足够电压的直流电源正、负极时,形成电解池,b与负极相连为阴极,阳离子向阴极移动,所以Cu2+向Fe电极移动,故C错误;
D.无论a和b是否用导线连接,均发生Fe+Cu2+=Cu+Fe2+,则铁片均溶解,溶液从蓝色逐渐变成浅绿色,故D正确;
故选C.
点评 本题考查原电池和电解池,明确原电池及电解池的中发生的电极反应、电极判断及发生的总反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容器内X、Y、Z的速率之比为1:2:2 | |
| B. | 单位时间生成0.1 mol X的同时生成0.2 mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | 容器内气体密度不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:
某化学兴趣小组同学利用侯德榜制碱法的原理制得了一些纯碱,经检验,样品中含有少量NH4Cl.现欲用实验测定样品的纯度,设计了多种探究方案:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
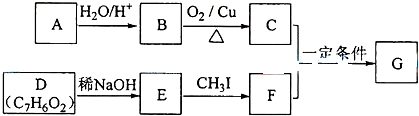
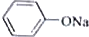 +RCH2I→
+RCH2I→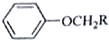
 .
.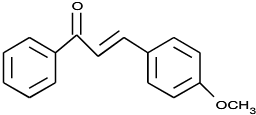 .
.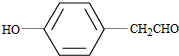 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明盐酸是强酸:2HCl+CaCO3═CaCl2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com