
| A.HIO>H2O2>I2 | B.H2O2>HIO>I2 | C.H2O2>I2>HIO | D.I2>H2O2>HIO |
科目:高中化学 来源:不详 题型:计算题
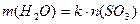 分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是:
分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是: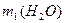 =______
=______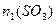 ,
,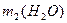 =______
=______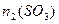 ;
;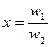 ,
,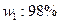 的硫酸的质量,
的硫酸的质量,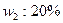 的发烟硫酸的质量)与
的发烟硫酸的质量)与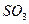 用量之比的关系是:
用量之比的关系是: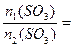 ___________x;
___________x;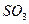 的物质的量一定,x随市场需求而有改变,则用水总量
的物质的量一定,x随市场需求而有改变,则用水总量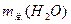 、x、
、x、 的关系式是_________________。
的关系式是_________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.臭氧的氧化性比氧气强,常温下能将银、汞等较不活泼的金属氧化 |
| B.臭氧可以杀死许多细菌,是一种良好的消毒剂 |
| C.臭氧和活性炭一样,能够吸附有机色素,是一种良好的脱色剂 |
| D.臭氧和氧气在一定条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(Ⅰ)(Ⅱ)(Ⅲ) |
| B.(Ⅱ)(Ⅲ)(Ⅰ) |
| C.(Ⅲ)(Ⅱ)(Ⅰ) |
| D.(Ⅱ)(Ⅰ)(Ⅲ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用石膏制SO2的反应是一个还原反应 |
| B.SO2转化为SO3是体积减小的可逆反应,为提高转化率,工业上一般采取加压 |
| C.水泥工业要用纯碱为原料 |
| D.《京都议定书》的签订对以上的硫酸生产方式没有影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com