
| A. | 在蒸发皿中放入NaCl溶液,加热NaCl溶液制取NaCl晶体 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用酒精萃取溴水中的溴单质 |
分析 A.水易挥发,氯化钠难挥发,可以采用加热方法分离;
B.选取量筒规格应该等于或稍大于量取溶液体积;
C.托盘天平感量是0.1g;
D.萃取剂不能和原溶剂互溶.
解答 解:A.水易挥发,氯化钠难挥发,可用蒸发分离,故A正确;
B.用量筒量取5.2mL的盐酸,应选择略大于5.2mL的量程,应选择10mL的量筒,故B正确;
C.托盘天平可以精确到0.1g,能称取25.2gNaCl,故C错误;
D.乙醇和水互溶,则乙醇不能作萃取剂,应该选取四氯化碳或苯,故D错误;
故选A,
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、仪器选取、萃取剂的选取等知识点,明确物质性质、物质分离和提纯方法与物质性质关系、仪器用途及规格是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
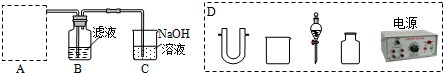
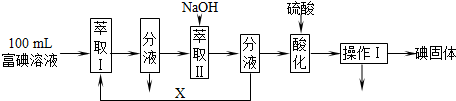
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| C. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com