
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜制品在潮湿空气中生锈,其主要原因是发生了析氢腐蚀 | |
| B. | 铜的电解精炼工业中,沉积在电解槽底部的阳极泥可作为提炼金、银等贵重金属的原料 | |
| C. | 泡沫灭火器中所装试剂为Na2CO3和Al2(SO4)3 | |
| D. | 从海水中可以制取NaCl,电解饱和NaCl溶液可以制金属Na |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
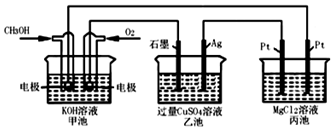
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它属于芳香烃 | B. | 分子中所有的碳原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
| 质量分数(%) | ? | 4.0 | 32 | 10.2 | 16 |
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
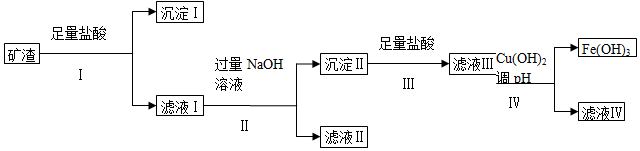
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com