
将100 mL 0.30 mol·L-1的Na2SO4溶液和50 mL 0.20 mol·L-1的Al2(SO4)3溶液混合后,所得溶液中SO42-的物质的量浓度为
A.0.20 mol·L-1 B.0.25 mol·L-1
C.0.40 mol·L-1 D.0.50 mol·L-1
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是______________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是______________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2——K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是__________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
A. X与Y形成的化合物只有一种
B. R的氢化物的热稳定性比W的强
C. 原子半径:r(Z)<r(R)
D. Y的最高价氧化物的水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是
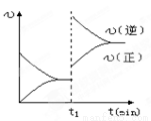
A.2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0
4NO(g)+6H2O(g);△H<0
C.H2(g)+I2(g) 2HI(g);△H>0
2HI(g);△H>0
D.N2(g) +3H2(g)  2 NH3(g) △H<0
2 NH3(g) △H<0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列对于“物质的量”或“摩尔”的理解正确的是
A.物质的量是国际科学界建议采用的一种物理量
B.物质的量是摩尔的单位,符号为n
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来的物理量
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1mol
查看答案和解析>>
科目:高中化学 来源:2016届湖北省枣阳市高三上学期第一次月考化学试卷(解析版) 题型:推断题
(15分)常见的五种盐X、Y、Z、M、N,它们的阴 离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是_________;所含阴离子相同的两种盐的化学式是_____________。
(2)M的化学式为_______________,M溶液显碱性的原因是________________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是______________;N和氨水反应的离子方程式是__________________。
(4)若要检验Y中所含的阳离子,正确的实验方法是______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期9月月考化学试卷(解析版) 题型:选择题
下同温同压下,等质量的下列气体所占有的体积最大的是
A.O3 B.CH4 C.CO D.N2
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月第一次月考化学试卷(解析版) 题型:选择题
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84gNaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中

下列叙述正确的是
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
查看答案和解析>>
科目:高中化学 来源:2016届湖南省浏阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
向质量分数为2a%,体积为10 mL,物质的量浓度为c1 mol·L-1的稀H2SO4中加入V mL 的水,使之质量分数变为 a%,此时物质的量浓度为c2 mol·L-1,则下列关系正确的是
A.V>10, 2c2=c1 B.V<10,2c2﹤c1
C.V>10,2c2<c1 D.V>10, 2c2>c1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com