(1)实验室制取氢氧化铁胶体的方法是______,可用______(方法)证明胶体已经制成.
(2)现有以下物质:①NaCl晶体 ②干冰③稀醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的KNO3⑨氨水 ⑩冰醋酸(纯净的醋酸CH3COOH)
请回答下列问题(用序号):以上物质中能导电的是______;以上物质中属于电解质的是______.
解:(1)实验室用向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈褐色的方法制备氢氧化铁胶体,胶体具有丁达尔效应,可用于鉴别胶体和其它分散系,是胶体的特征性质,
故答案为:向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈褐色;丁达尔效应;
(2)电解质是在熔融状态或水溶液中能导电的化合物,包括大多数酸、碱盐,①⑤⑧⑩属于电解质,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电,③④⑧⑨能导电,故答案为:③④⑧⑨; ①⑤⑧⑩.
分析:(1)实验室用向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈褐色的方法制备氢氧化铁胶体,胶体具有丁达尔效应;
(2)电解质是在熔融状态或水溶液中能导电的化合物,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电.
点评:本题考查胶体的制备及性质,以及电解质等概念,题目难度不大,注意能导电的物质的类别.



 名校课堂系列答案
名校课堂系列答案 (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: H2+I2
H2+I2 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=


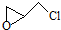 ,则该有机物核磁共振氢谱有
,则该有机物核磁共振氢谱有