
| A. | 邻二甲苯( )、邻羟基苯甲醛( )、邻羟基苯甲醛(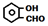 )熔沸点均于其对应对位取代物 )熔沸点均于其对应对位取代物 | |
| B. | 卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高 | |
| C. | 石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低 | |
| D. | NaCl、MgCl2、MgO、Al2O3熔沸点依次减小 |
分析 A.对羟基苯甲醛可形成分子间氢键,熔沸点较高;
B.分子晶体,分子间作用力越大即含有氢键,晶体的熔点越高;
C.一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>金属晶体>分子晶体,原子晶体,原子半径越小,共价键键能越大,则熔点越高,分子晶体,分子间作用力越大,晶体的熔点越高;
D.离子晶体,则阴阳离子所带电荷数越多,半径越小,晶格能越大,熔沸点越高.
解答 解:A.对羟基苯甲醛可形成分子间氢键,熔沸点较高,而邻羟基苯甲醛主要存在分子内氢键,所以对羟基苯甲醛熔沸点高于邻羟基苯甲醛,故A错误;
B.卤素元素的单质及其氢化物都属于分子晶体,分子间作用力越大,晶体的熔点越高,所以卤素元素的单质熔沸点随原子半径的增大而升高,而HF由于形成分子间氢键使得分子间作用力更大,所以其氢化物的熔沸点应为HF>HI>HBr>HCl,故B错误;
C.一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>金属晶体>分子晶体,又金刚石、碳化硅、晶体硅都为原子晶体,原子半径C<Si,原子半径越小,共价键键能越大,则熔点越高,所以金刚石、碳化硅、晶体硅熔沸点依次降低,又白磷、水、干冰都是分子晶体,常温下白磷为固态,水为液态,干冰为气态,所以熔沸点依次降低,而石墨为混合晶体不但含有碳碳共价键,还含有其他作用力,熔沸点比金刚石还高,所以石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低,故C正确;
D.NaCl、MgCl2、MgO、Al2O3都是离子晶体,则阴阳离子所带电荷数越多,半径越小,晶格能越大,熔沸点越高,所以NaCl、MgCl2、MgO、Al2O3熔沸点依次增大;故D错误.
故选C.
点评 本题考查晶体的熔沸点高低的比较,题目难度不大,注意比较晶体熔沸点高低的角度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 对甲苯酚和苯甲醇 | B. | 甲酸甲酯和甲醛 | ||
| C. | 苯和乙烯 | D. | CH3CH2OH和CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:
用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③④⑦ | B. | 只有⑤⑥⑧⑨⑩ | C. | 只有①③⑤⑦⑨ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
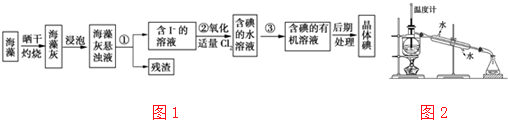
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com