
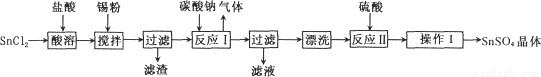
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备的工艺流程如下:
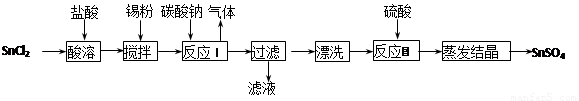
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是 ,加入锡粉的作用是 。
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
。
(3) 检验沉淀已经“洗涤”干净的操作是: 。
(4)反应II硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10-26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因: 。
(16分)
(1)抑制Sn2+水解(2分) 防止Sn2+被氧化(2分)
(2)SnCl2 + Na2CO3 = SnO↓ + CO2↑+2NaCl(2分)
(3)取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净。(3分)
(4)小于1 (3分。若写成≤1给1分)
(5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O(2分)
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化。(2分)
【解析】
试题分析:(1)SnCl2是强酸弱碱盐,能水解,即SnCl2+2H2O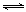 Sn(OH)2+2HCl,直接用水溶解或稀释能促进Sn2+水解,用盐酸溶解,增大氢离子或氯化氢浓度使水解平衡向逆反应方向移动,即抑制Sn2+水解;读图可知,目标产物是SnSO4,其中所含锡元素的化合价为+2价,已知锡在水溶液中有Sn2+、Sn4+,说明加入锡粉的主要目的是防止Sn2+氧化为Sn4+或者将Sn4+还原为Sn2+;(2)Na2CO3与HCl容易发生反应,生成NaCl、H2O和CO2气体,促进SnCl2水解,生成的Sn(OH)2易分解为SnO沉淀和水,根据工艺流程图顺推和逆推,反应I的反应物为SnCl2、Na2CO3,生成物为SnO、NaCl、CO2,由于没有元素化合价变化,则反应I属于复分解反应,根据质量守恒定律,则SnCl2+Na2CO3=SnO↓+CO2↑+2NaCl;(3)由于沉淀具有较强的吸附性,则SnO沉淀中吸附了可溶性的NaCl和过量的Na2CO3,因此检验沉淀已经洗涤干净的方法是设计焰色反应不是黄色或检验氯离子或碳酸根离子的实验方案,最简单合理的操作是取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;(4)由于Sn(OH)2(s)
Sn(OH)2+2HCl,直接用水溶解或稀释能促进Sn2+水解,用盐酸溶解,增大氢离子或氯化氢浓度使水解平衡向逆反应方向移动,即抑制Sn2+水解;读图可知,目标产物是SnSO4,其中所含锡元素的化合价为+2价,已知锡在水溶液中有Sn2+、Sn4+,说明加入锡粉的主要目的是防止Sn2+氧化为Sn4+或者将Sn4+还原为Sn2+;(2)Na2CO3与HCl容易发生反应,生成NaCl、H2O和CO2气体,促进SnCl2水解,生成的Sn(OH)2易分解为SnO沉淀和水,根据工艺流程图顺推和逆推,反应I的反应物为SnCl2、Na2CO3,生成物为SnO、NaCl、CO2,由于没有元素化合价变化,则反应I属于复分解反应,根据质量守恒定律,则SnCl2+Na2CO3=SnO↓+CO2↑+2NaCl;(3)由于沉淀具有较强的吸附性,则SnO沉淀中吸附了可溶性的NaCl和过量的Na2CO3,因此检验沉淀已经洗涤干净的方法是设计焰色反应不是黄色或检验氯离子或碳酸根离子的实验方案,最简单合理的操作是取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;(4)由于Sn(OH)2(s)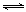 Sn2++2OH-,则Ksp[Sn(OH)2]=c(Sn2+)•c2(OH-),即c2(OH-)= Ksp[Sn(OH)2]/c(Sn2+),c(OH-)=
1.0×10-13mol/L;由于Kw= c(H+)•c(OH-)= 1.0×10-14,则c(H+)= Kw/c(OH-)= 1.0×10-1 mol/L,则pH=—lg c(H+)=1;为了防止析出Sn(OH)2沉淀,必须使溶液中Qc[Sn(OH)2]<Ksp[Sn(OH)2],则c(OH-)
<1.0×10-13mol/L,即c(H+)>1.0×10-1
mol/L,pH<1;(5)双氧水具有氧化性,能将锡元素从+2价氧化为+4价,而过氧化氢被还原为水,根据最小公倍数法配平,由电子、电荷和原子守恒可得:Sn2+ + H2O2 +
2H+ = Sn4+ + 2H2O;(6)金属活动顺序表中锡位于铜前,构成原电池时,锡是负极,铜是正极,则锡被腐蚀,铜被保护,即使锡层破损也能防止铜腐蚀,这是牺牲阳极的阴极保护法的应用。
Sn2++2OH-,则Ksp[Sn(OH)2]=c(Sn2+)•c2(OH-),即c2(OH-)= Ksp[Sn(OH)2]/c(Sn2+),c(OH-)=
1.0×10-13mol/L;由于Kw= c(H+)•c(OH-)= 1.0×10-14,则c(H+)= Kw/c(OH-)= 1.0×10-1 mol/L,则pH=—lg c(H+)=1;为了防止析出Sn(OH)2沉淀,必须使溶液中Qc[Sn(OH)2]<Ksp[Sn(OH)2],则c(OH-)
<1.0×10-13mol/L,即c(H+)>1.0×10-1
mol/L,pH<1;(5)双氧水具有氧化性,能将锡元素从+2价氧化为+4价,而过氧化氢被还原为水,根据最小公倍数法配平,由电子、电荷和原子守恒可得:Sn2+ + H2O2 +
2H+ = Sn4+ + 2H2O;(6)金属活动顺序表中锡位于铜前,构成原电池时,锡是负极,铜是正极,则锡被腐蚀,铜被保护,即使锡层破损也能防止铜腐蚀,这是牺牲阳极的阴极保护法的应用。
考点:考查有关物质制备的化学工艺流程,涉及解释加入试剂的原因和作用、书写关键步骤的化学方程式、设计检验沉淀是否洗涤干净的实验方案、溶度积和水的离子积的有关计算、书写主要流程的离子方程式、根据原电池原理解释锡层破损也能防止铜腐蚀的原因等。


科目:高中化学 来源:2013-2014学年山东省淄博市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是??????????????????????? 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有????????????? ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为???????????????? 。
③步骤Ⅴ涉及到的操作有:a.过滤? b.洗涤? c.蒸发浓缩? d.冷却结晶? e.低温干燥,则其正确的操作顺序为??????????????????????? 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
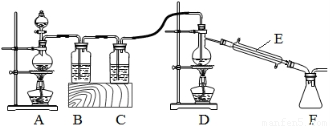
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com