
(1)根据VSEPR模型:
ClO3-的价层电子对的几何分布呈________型,离子的空间结构呈________型;
CH2Cl2的价层电子对的几何分布呈________型,分子的空间结构呈________型;
(3)按要求写出由第三周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体形分子________,三角锥形分子________,V形分子________;
(4)与SO42-互为等电子体的微粒(举两例)________;
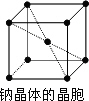
(5)金属钠的晶胞如下图所示,实验测得钠的密度为d(g·cm-3).已知钠的相对原子质量为M,阿伏加德罗常数为NA(mol-1),假定金属钠原子
为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为________;
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,
的未成对电子数是 。
(3)中的
与
互为等电子体。已知
、
两种粒子中各原子最外层均为8电子稳定结构。
的电子式可表示为 ;
中含有的
键数目为 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年山东省莘县一中高二下学期第一次月考化学试卷 题型:填空题
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 , 的未成对电子数是 。
的未成对电子数是 。
(3)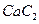 中的
中的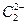 与
与 互为等电子体。已知
互为等电子体。已知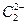 、
、 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。 的电子式可表示为 ;
的电子式可表示为 ; 中含有的
中含有的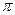 键数目为 。
键数目为 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省高二下学期第一次月考化学试卷 题型:填空题
(8分)研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,
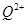 的未成对电子数是 。
的未成对电子数是 。
(3)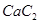 中的
中的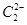 与
与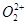 互为等电子体。已知
互为等电子体。已知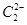 、
、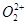 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。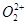 的电子式可表示为 ;
的电子式可表示为 ;
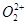 中含有的
中含有的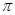 键数目为
。
键数目为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com