
下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq)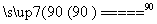 NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)

(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________________________________________________________________________
________________________________________________________________________。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见上图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)____________________、干燥。
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如下图所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按下图所示组装仪器,检查装置气密性。
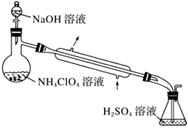
步骤2:准确称取样品a g(约0.5 g)于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL约0.1 mol·L-1H2SO4溶液于锥形瓶中。
步骤4:经分液漏斗向蒸馏烧瓶中加入20 mL 3 mol·L-1NaOH溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤8:将实验步骤1~7重复2次。
①步骤3中,准确量取40.00 mL H2SO4溶液的玻璃仪器是__________________________。
②步骤1~7中,确保生成的氨被稀硫酸完全吸收的实验步骤是_________________
(填步骤序号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560 ℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
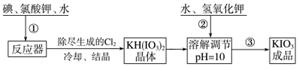
(1)步骤②中氢氧化钾的主要作用是_____________________________________。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过________、过滤、洗涤、干燥等步骤。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100 g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O;I2+2S2O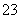 ===2I-+S4O
===2I-+S4O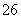
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取w g食盐、加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3 mol·L-1的Na2S2O3溶液滴定,消耗10.00 mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为________、______。
②该实验可以用________作指示剂,滴定终点的现象是________________________。
③下列有关该滴定实验的说法不正确的是________(填序号)。
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是________(以含w的代数式表示)g·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:
Al3++4NH3·H2O===AlO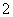 +4NH
+4NH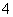 +2H2O
+2H2O
B.浓烧碱溶液中加入铝片:
Al+2OH-===AlO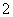 +H2↑
+H2↑
C.用浓NaOH溶液溶解Al2O3:
2OH-+Al2O3===2AlO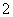 +H2O
+H2O
D.往碳酸镁中滴加稀盐酸:
CO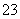 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140.5 kJ·mol-1
C(s,石墨)+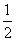 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
A.+80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.-80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇液体,可选用的最佳试剂是
( )。
A.溴水、新制的Cu(OH)2
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水
D.KMnO4酸性溶液、石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:

(1)如何从试剂瓶中取用金属钠?剩余的Na能否放回原试剂瓶?
(2)有关钠反应的现象是_______________________________。
(3)大试管的溶液中出现的现象:_________________________________。
(4)装置中液面的变化:大试管内______;长颈漏斗内____。
(5)写出钠与硫酸亚铁溶液反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
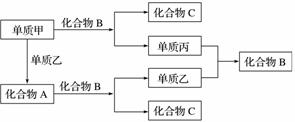
(1)A、B、C的化学式分别为________、______、______。
(2)单质甲与化合物B反应的离子方程式为__________。
(3)在A、B、C三种化合物中,必定含有的元素是__________________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com