
| m |
| V |
| M |
| Vm |
| m |
| V |
| 8 |
| 2 |
| 5 |
| 1 |
| M |
| Vm |


科目:高中化学 来源: 题型:
| A、2K+2H2O=2KOH+H2↑ | |||
| B、2Na+2C2H5OH→2C2H5ONa+H2↑ | |||
| C、Na2CO3+H2O=NaHCO3+NaOH | |||
D、CH3COOH+CH3CH2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:Na>Mg>Al |
| D、离子键由强到弱:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g-14CH3所含的中子数为9NA |
| B、39g钾发生氧化还原反应时,一定失去NA个电子 |
| C、标准状况时,22.4L二氯甲烷所含有的分子数为NA |
| D、常温常压下,1mol氦气含有的核外电子数为 4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
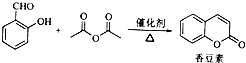
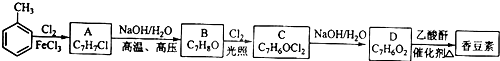
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com