
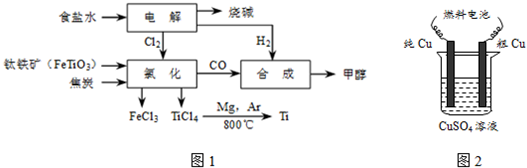
分析 (1)从图示可知钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳,依据原子守恒配平写出该反应的方程式;
(2)①根据浓度熵数值和平衡常数的大小关系来判断;
②根据CO和H2合成甲醇的方程式:CO(g)+2H2(g)?CH3OH(g)以及2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO和2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得到相应关系式来计算;
(3)①根据负极反应=总反应-正极反应来回答;
②根据电路中的电子守恒来计算回答;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(OH{\;}^{-}).c(NH{\;}_{4}{\;}^{+})}{c(NH{\;}_{3}.H{\;}_{2}O)}$,据此计算.
解答 解:(1)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3+2TiCl4+6CO;
(2)①将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此状态的浓度熵Qc=$\frac{C{\;}_{(甲醇)}}{C{\;}_{(一氧化碳)}C{{\;}_{(氢气)}}^{2}}$=$\frac{1}{1×1.5{\;}^{2}}$=0.44>0.27,即Qc>K,所以此时反应将向逆反应方向进行,v(正)<v(逆),
故答案为:<;
②由方程式CO(g)+2H2(g)?CH3OH(g)、2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO和2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑得如下关系式:6CH3OH→6CO→7Cl2→7H2,而6CH3OH→12H2,故每生产6molCH3OH(192g)需额外补充5molH2(10g),则生产19.2t甲醇,至少需额外补充1.0t氢气,
故答案为:1.0;
(3)①甲醇-空气碱性(KOH)燃料电池的总反应为:3O2+2CH3OH+4OH-=2CO32-+6H2O,正极反应式为:3O2+12e-+6H2O=12OH-,负极反应=总反应-正极反应,即为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②电解精炼粗铜时,阴极电极反应为:Cu2++2e-=Cu,当生成3.2g纯铜,至少转移电子0.1mol,燃料电池的正极反应为:3O2+12e-+6H2O=12OH-,转移电子0.1mol,消耗氧气0.025mol,折合成空气为0.125mol,在标准状况下的体积为2.8L,故答案为:2.8L;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(OH{\;}^{-}).c(NH{\;}_{4}{\;}^{+})}{c(NH{\;}_{3}.H{\;}_{2}O)}$=$\frac{10{\;}^{-7}×5×10{\;}^{-3}}{0.5a-5×10{\;}^{-3}}$=$\frac{10{\;}^{-9}}{a-0.01}$,
故答案为:中;$\frac{10{\;}^{-9}}{a-0.01}$.
点评 本题主考查了化学方程式的书写及计算、平衡移动动的判断、电解原理的应用、盐类的水解等知识,要求学生具有分析和解决问题的能力,难度中等,有一定的综合性.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
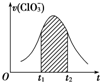 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 图中阴影部分“面积”可以表示t1-t2时间为c(Cl-)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 滴入KI试液 | 检验淀粉是否已完全水解 |
| C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此电池能发出蓝色火焰 | |
| B. | H2为正极,O2为负极 | |
| C. | 工作时,电解液的pH不断增大 | |
| D. | 此电池反应只生成水,对环境没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一取代物无同分异构体 | |
| B. | 苯不易跟溴、氯发生加成反应 | |
| C. | 苯分子中碳原子之间以单双键交替存在 | |
| D. | 苯不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4是氧化产物 | |
| B. | 配平后,OH-的化学计量数是2 | |
| C. | 生成3.2g N2H4 转移0.1mol 电子 | |
| D. | 氧化剂与还原剂物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com