
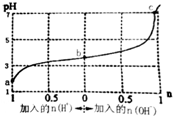
| A�� | b����Һ��c��A-����c��Na+����c��HA�� | |
| B�� | ͨ��HCl��c��HA��/c��A-������ | |
| C�� | ������1 mol NaOH����Һ��c��Na+��=c��A-�� | |
| D�� | a��b��c������Һ��ˮ�ĵ���̶��������� |
���� A��δ��HCl��NaOHʱ����Һ�����ԣ�˵��HA�ĵ���̶ȴ���A-ˮ��̶ȣ�
B��ͨ��HCl��NaA��HCl��Ӧ����HA��
C������1mol NaOH��pH��7����Һ�ʼ��ԣ���ϵ���غ��жϣ�
D��A��B��Һ�����ԣ�����ˮ�ĵ��룬C�����ԣ��Դ��жϣ�
��� �⣺A��δ��HCl��NaOHʱ����Һ�����ԣ�˵��HA�ĵ���̶ȴ���A-ˮ��̶ȣ���b����Һ��c��A-����c��Na+����c��HA������A��ȷ��
B��ͨ��HCl��NaA��HCl��Ӧ����HA������c��HA������c��A-����С������c��HA��/c��A-������B��ȷ��
C������1mol NaOH��pH��7����Һ�ʼ��ԣ�����H+����c��OH-�����ɵ���غ��֪c��Na+����c��A-������C����
D��A��B��Һ�����ԣ�����ˮ�ĵ��룬C�����ԣ�pHԽС������Խǿ��ˮ�ĵ���̶�ԽС����a��b��c��������ʾ����Һ��ˮ�ĵ���̶���������D��ȷ��
��ѡC��
���� ���⿼������ϵĶ����жϺͼ��㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע�����ͼ��������ϢΪ������Ĺؼ����Ѷ��еȣ�


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��Cl2�о���ȼ�գ�������ɫ���棬ð���� | |
| B�� | SiO2�Ļ�ѧ���ʲ����ã������κ��ᷢ����Ӧ | |
| C�� | �����£���������Ũ����ᷢ���ۻ���Ӧ | |
| D�� | ������ͨ����ɫʯ����Һ��һЩʱ�����Һ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� HClO+OH-��
HClO+OH-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
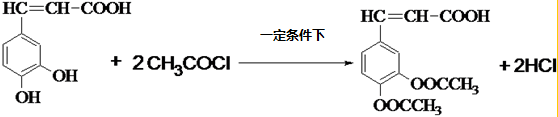
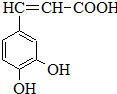 �����ᣨ��ͼ����������������ҩ�У���Ұ���ܲ�����Ҷˮ�ա�����ľ���ĵȣ���������ֹѪ���ã��ر�������ֹѪЧ���Ϻã�
�����ᣨ��ͼ����������������ҩ�У���Ұ���ܲ�����Ҷˮ�ա�����ľ���ĵȣ���������ֹѪ���ã��ر�������ֹѪЧ���Ϻã�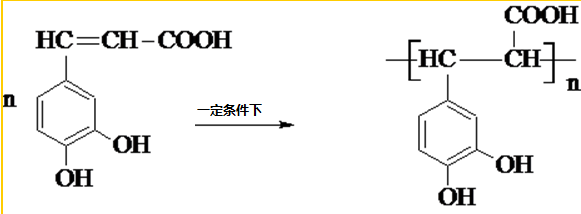 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe3+ | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������pH=2��������pH=12�İ�ˮ�������϶��� | |
| B�� | ����Һ�����ɵ����ʵ���Ũ�ȵ�����Ͱ�ˮ�������϶��� | |
| C�� | ����������ˮ����Һ������Ũ�ȿ���Ϊ��c ��NH4+����c ��Cl-����c ��OH-����c��H+�� | |
| D�� | ����Һ��c ��NH4+��=c ��Cl-��+c ��OH-��-c��H+�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com