
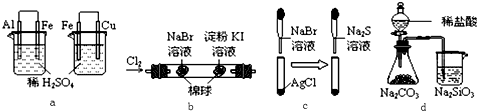
| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl<AgBr<Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.一般来说,在原电池中较活泼金属作负极、较不活泼金属作正极;
B.氯气和溴都能氧化碘离子生成碘;
C.溶解度大的物质能转化为溶解度小的物质;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.一般来说,在原电池中较活泼金属作负极、较不活泼金属作正极,a中左边装置Fe上有气泡、右边Cu上有气泡,说明左边装置Fe作正极、右边装置Cu作正极,则金属活动性Al>Fe>Cu,故A正确;
B.氯气和溴化钠不能完全反应,氯气和溴都能氧化碘离子生成碘,从而干扰实验,所以不能得出此结论,故B错误;
C.溶解度大的物质能转化为溶解度小的物质,根据固体颜色变化知,溶解度:AgCl>AgBr>Ag2S,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,盐酸易挥发,导致生成的二氧化碳中含有HCl,HCl和碳酸钠也反应生成硅酸沉淀,从而干扰实验,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及金属活动性强弱判断、物质溶解度大小判断、物质氧化性强弱判断、非金属性强弱判断等知识点,明确物质性质及实验原理是解本题关键,注意排除其它因素干扰,易错选项是D,如果将盐酸换为稀硫酸则能判断S、C、Si的非金属性强弱.


科目:高中化学 来源: 题型:选择题
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠作用时,键①断 | |
| B. | 燃烧时,①②③④⑤键均断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
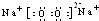 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
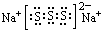 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;CO2的电子式
;CO2的电子式 ;NH4Cl的电子式
;NH4Cl的电子式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
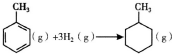 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com