
25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒)
CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
解析试题分析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
考点:考查离子方程式的书写;物质的量浓度的相关计算;弱电解质在水溶液中的电离平衡


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: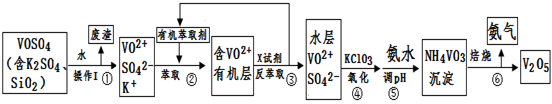
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。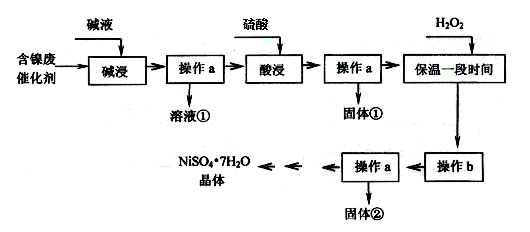
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
 2Ni(OH)2,写出该反应放电时正极反应式 。
2Ni(OH)2,写出该反应放电时正极反应式 。 。
。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
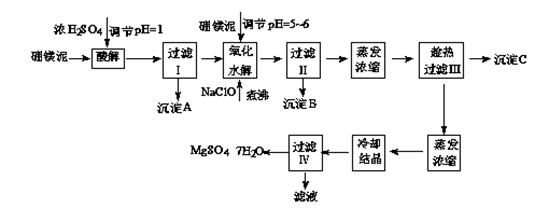
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(5) 25℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: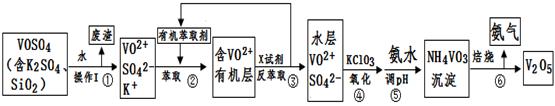
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法: 。
(3)乙方案中,说明HA是弱电解质的现象是
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com