
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4— (绿色)、Cr2O72— (橙红色)、CrO42— (黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_____。
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42-的平衡转化率____(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
【答案】蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 2CrO42-+2H+![]() Cr2O72—+H2O 增大 1.0×1014 小于
Cr2O72—+H2O 增大 1.0×1014 小于
【解析】
(1)溶液Cr3+(蓝紫色)和氢氧化钠溶液反应生成Cr(OH)3为难溶于水的灰蓝色固体,和氢氧化铝性质相似为两性氢氧化物,能溶于强碱;(2)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;A点c(Cr2O72-)=0.25mol/L,c(H+)=10-7mol/L,c(CrO42-)=0.5mol/L,依据平衡常数概念计算,K= c(Cr2O72-)/ c2(H+)![]() c2(CrO42-);②溶液酸性增大,平衡2CrO42-+2H+Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,c(H+)=1×10-7mol/L,计算反应的平衡常数;③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断。
c2(CrO42-);②溶液酸性增大,平衡2CrO42-+2H+Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,c(H+)=1×10-7mol/L,计算反应的平衡常数;③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,升高温度平衡向吸热方向移动,据此判断。
(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色Cr(OH)4;答案为:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
(2)①随着H+浓度的增大,CrO42转化为Cr2O72的离子反应方程式为:2CrO42-+2H+Cr2O72—+H2O,答案为:2CrO42-+2H+ Cr2O72—+H2O 。
②溶液酸性增大,平衡2CrO42-+2H+Cr2O72—+H2O正向进行, CrO42的平衡转化率增大;A点Cr2O72的浓度为0.25mol/L,则消耗的CrO42的浓度为0.5mol/L,则溶液中的c(CrO42)=1.0mol/L0.25mol/L×2=0.5mol/L,c(H+)浓度为1×107mol/L,此时该转化反应的平衡常数为K=c(Cr2O72)/c2(H+)c2(CrO42)=0.25/0.52×(107)2=1.0×1014,答案为:增大;1.0×1014。
③升高温度,溶液中CrO42的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,答案为:小于。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各式表示水解反应方程式的是( )
A.HCO3-+H2O![]() H3O++CO32-B.HS-+H2O
H3O++CO32-B.HS-+H2O![]() H2S+OH-
H2S+OH-
C.Cu2++H2O![]() Cu(OH)2↓+2H+D.HCO3-+OH-
Cu(OH)2↓+2H+D.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L
C.3.01×1023个SO2分子质量为32 g
D.标准状况下,1mol任何物质体积均为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X____。
(2)上述实验流程中①②③步均要进行的实验操作是____(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是____________。
(4)按此实验方案得到的溶液3中肯定含有杂质。为了解决这个问题,可以向溶液3中加入适量的________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种酸,草酸晶体(H2C2O42H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
(1)草酸的水溶液的pH___7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO。
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是____;
②最后用图1装置收集CO,气体应从___端进入(选填“a”或“b”)。
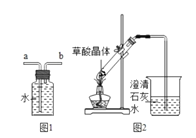
(3)实验图2中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是___。
按图3装置将草酸钙晶体(H2C2O4xH2O)样品高温加热,使其完全分解。

(4)B中观察到硫酸铜变蓝,说明反应生成了_____;
(5)C、G中澄清石灰水均变浑浊,说明反应还生成___和___气体。
(6)反应开始前通入氮气的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molH2和1molI2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20mL0.1 mol/LAlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
A. 
微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+
B. 
反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
C. 
恒温恒容条件下,发生的可逆反应2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
D. 
利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com