
分析 (1)根据反应前后元素种类不变,推出G中含有氮元素,根据元素质量分数确定原子个数,从而确定化学式;
(2)根据反应物与生成物正确写出化学方程式;
(3)根据化合物中正负化合价代数和等于0计算及高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料判断晶体类型.
解答 解:(1)化合物E(含两种元素)与NH3反应制得G和HCl,根据化学反应前后元素种类不变可知G中含有氮元素,故Y为氮元素,设G化合物的化学式为:SiaNb.化合物G的相对分子质量为140,含有硅元素,其质量分数为60%,故60%=$\frac{28×a}{28×a+14×b}$×100%,求得$\frac{a}{b}$=$\frac{3}{4}$,故G的化学式为Si3N4;E的化学式为SiCl4
,故答案为:Si3N4;SiCl4 ;
(2)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分为氮气,另一种是氧化物为二氧化硅,故化学方程式为:Si3N4+3O2$\frac{\underline{\;高温\;}}{\;}$3SiO2+2N2 ,故答案为:Si3N4+3O2$\frac{\underline{\;高温\;}}{\;}$3SiO2+2N2 ;
(3)“赛伦”化学式 Si6-xAlxOxY8-x. 在1400℃时x为2.0,其化学式为Si4Al2O2Y6 ,其中Si元素的化合价为+4价,Al为+3价,O为-2价,根据化合价代数和为0,则“赛伦”中Y元素的化合价为-3价,又“赛伦”是高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,所以为原子晶体,故答案为:+4;-3; 原子晶体.
点评 解答本题关健根据反应前后元素种类不变确定出组成元素,再根据元素质量分数确定出化学式,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=12和pH=8的氢氧化钠溶液等体积混合后溶液的pH值为10 | |
| B. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| C. | 0.2 mol•L-1与0.1 mol•L-1醋酸中c(H+)之比为2:1 | |
| D. | NO2溶于水时,氧化产物与还原产物的质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中可能含有乙烷 | D. | 混合气体中一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
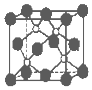 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A. | 磷化硼晶体的化学式为BP,属于离子晶体 | |
| B. | 磷化硼晶体的熔点高,且熔融状态下能导电 | |
| C. | 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 | |
| D. | 磷化硼晶体中每个原子均形成4个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
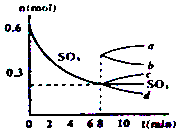 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com