
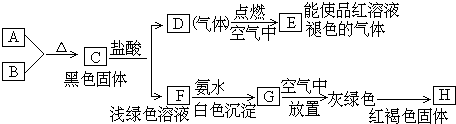
分析 D燃烧得到气体E能使品红溶液褪色,则E为SO2,F与氨水反应得到G,而G放置空气中变为灰绿色,最终变为红褐色固体H,则G为 Fe(OH)2,H为 Fe(OH)3,黑色粉末单质A与黄色粉末单质B反应得到黑色固体C,而C与盐酸反应得到D与F,可推知A为Fe、B为S,C为FeS,D为H2S,F为FeCl2,据此解答.
解答 解:D燃烧得到气体E能使品红溶液褪色,则E为SO2,F与氨水反应得到G,而G放置空气中变为灰绿色,最终变为红褐色固体H,则G为 Fe(OH)2,H为 Fe(OH)3,黑色粉末单质A与黄色粉末单质B反应得到黑色固体C,而C与盐酸反应得到D与F,可推知A为Fe、B为S,C为FeS,D为H2S,F为FeCl2.
(1)根据上述反应现象推断E为SO2,故答案为:SO2;
(2)C+盐酸→D+F的化学方程式:FeS+2HCl=FeCl2+H2S↑,F→G的化学方程式:Fe2++3NH3•H2O=Fe(OH)2↓+3NH4+,
故答案为:FeS+2HCl=FeCl2+H2S↑;Fe2++3NH3•H2O=Fe(OH)2↓+3NH4+.
点评 本题考查无机物推断,物质的颜色及反应现象是推断突破口,需要学生熟练掌握元素化合物知识,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:A>C | |
| B. | 可用单质的活泼性来比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | E元素的某化合物A2E2O8中E的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24LO2 | B. | 含NA个氢原子的H2 | ||
| C. | 22gCO2 | D. | 含3.01×1023个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | pH均为5 的盐酸和硫酸氢钠溶液中,水的电离程度后者大 | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
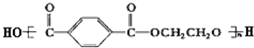
| A. | 合成涤纶纤维的单体为HOCH2CH2OH和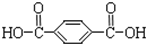 | |
| B. | 棉花和涤纶纤维在一定条件下均能水解 | |
| C. | 涤纶纤维和棉花均为混合物 | |
| D. | 棉花和涤纶纤维不能用燃烧法区别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com