
| A.不变 | B.降低 | C.升高 | D.无法确定 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。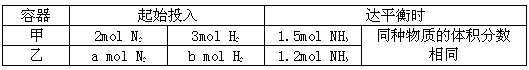
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 | D.形成1mol N N键的同时形成6molN—H键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在反应2FeCl3+Fe |
| B.相同温度下,0.2mol·L—1CH3COOH溶液与0.1mol·L—1CH3COOH溶液中c(H+) |
C.在密闭容器中,N2+3H2 2NH3已达平衡时c(NH3)与c(N2) 2NH3已达平衡时c(NH3)与c(N2) |
| D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2S+H2SO4(浓)=S↓+SO2↓+2H2O:6e- |
B.3Cl2+6KOH 5KCl+KClO3+3H2O:5e- 5KCl+KClO3+3H2O:5e- |
| C.2Na2O2+2H2O=4NaOH+O2↑:2e- |
| D.2H2S+SO2=3S+2H2O:4e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过化学变化一定能改变物质的性质 |
| B.人们所使用的材料,都是纯度越高越好 |
| C.氧化还原反应中一定会发生电子转移 |
| D.某元素由化合态变为游离态,该元素有可能被氧化,也有可能被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com