

分析 (1)18O原子中,2p上有4个电子,核外没有运动状态相同的单子;核外电子排布是1s22s22p4,p轨道上4个电子占据三个轨道;
(2)H2O、H2O2、H2S、H2S2,四种分子中,硫、氧原子均形成了2个σ键、还有2个孤电子对,杂化轨道数目均为4;
(3)分子的稳定性是由键能大小决定的;由于氢化物均是分子晶体,沸点的高低是由分子间作用力大小决定的,但水分子间可以形成氢键,H2S分子之间不能;
(4)非金属性越强,第一电离能越大;由CrO2Cl2的溶解性及CCl4是非极性分子知,CrO2Cl2最可能是非极性分子;
(5)根据均摊法可知,在一个晶胞中含有钇原子数为1、钡原子数为2,铜原子数为8×$\frac{1}{8}$+8×$\frac{1}{4}$=3,氧原子数为8×$\frac{1}{2}$+12×$\frac{1}{4}$=7,可以确定化学式,用阿伏伽德罗常数表示出晶胞质量,再根据m=ρV可求出体积.
解答 解:(1)18O原子中,2p上有4个电子,是四种不同的运动状态;核外电子排布是1s22s22p4,p轨道上4个电子占据三个轨道,则有两个未成对电子,
故答案为:4;2;
(2)H2O、H2O2、H2S、H2S2,四种分子中,硫、氧原子均形成了2个σ键、还有2个孤电子对,杂化轨道数目均为4,H2O、H2S均是V形分子,H2O2、H2S2两种分子中,中心原子的杂化轨道类型是sp3杂化,
故答案为:H2O、H2S;sp3杂化;
(3)分子的稳定性是由键能大小决定的,H-O键的键能比其他氢化物中的键能大,故水最稳当,
水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低,
故答案为:H-O键的键能比其他氢化物中的键能大;水分子间可以形成氢键而其他氢化物分子间不能形成氢键,故水的沸点最高,H2S分子间作用力最小,故沸点最低;
(4)非金属性越强,第一电离能越大,第一电离能由大到小的顺序为:O>Cl>Cr,
由CrO2Cl2的溶解性及CCl4是非极性分子知,CrO2Cl2最可能是非极性分子,故其最可能的结构为b,
故答案为:O>Cl>Cr;b;
(5)①根据均摊法可知,在一个晶胞中含有钇原子数为1、钡原子数为2,铜原子数为8×$\frac{1}{8}$+8×$\frac{1}{4}$=3,氧原子数为8×$\frac{1}{2}$+12×$\frac{1}{4}$=7,故化学式为:YBa2Cu3O7,
故答案为:YBa2Cu3O7;
②化学式为YBa2Cu3O7,摩尔质量为667 g/mol,则晶胞质量为$\frac{667}{{N}_{A}}$g,故ρg•cm-3×V=$\frac{667}{{N}_{A}}$g,解得V=$\frac{667}{ρ{N}_{A}}$cm3,
故答案为:$\frac{667}{ρ{N}_{A}}$cm3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型、氢键、电离能、分子结构与性质、晶胞计算等,(4)中关键是判断分子极性问题,为易错点,(5)中晶胞中氧原子数目计算容易出错,容易认为面上的O原子处于在棱上.


科目:高中化学 来源: 题型:选择题
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
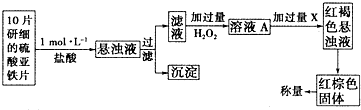
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
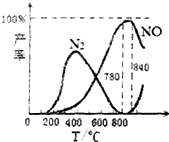
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸沉淀不溶解,说明该溶液一定存在SO42- | |
| D. | 浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量 | |
| C. | 2 molH2(g)和1 molO2(g)反应生成2 molH2O(1),共吸收484 kJ能量 | |
| D. | 2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com