
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1)NW3的电子式为___,HWO的结构式为__,Z在元素周期表中的位置是__,XO2分子中X原子采用杂化方式___。
(2)①X、Y、Z、W原子半径由大到小依次是___(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是__(填化学式)。
(3)X、Y、Z、W中第一电离能最小的是___,电负性最大的是___(填元素符号)。
【答案】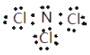 H-O-Cl 第三周期第ⅣA族 sp Al>Si>Cl>C HClO4>H2CO3>H2SiO3 Al Cl
H-O-Cl 第三周期第ⅣA族 sp Al>Si>Cl>C HClO4>H2CO3>H2SiO3 Al Cl
【解析】
X、Y、Z、W是短周期元素,原子序数依次递增,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y应为Al;Z原子的最外层电子数是次外层电子数的一半,且Z的原子序数大于Al,所以Z为Si元素,X与Z同主族,则X为C元素; Y、Z、W原子的最外层电子数之和为14,W的最外层电子数为14-3-4=7,W为Cl,以此来解答。
(1)NW3为NCl3,为共价化合物,N原子与每个Cl原子共用一对电子,且N原子还有一对孤电子对,所以NCl3的电子式为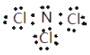 ;HClO的结构式为H—O—Cl;Z为Si元素,位于第三周期第ⅣA族;XO2为CO2,分子为直线形,C原子为sp杂化;
;HClO的结构式为H—O—Cl;Z为Si元素,位于第三周期第ⅣA族;XO2为CO2,分子为直线形,C原子为sp杂化;
(2)①Al、Si、Cl均位于第三周期,同周期主族元素的原子半径自左至右依次减小,C元素位于第二周期,原子半径最小,所以原子半径Al>Si>Cl>C;
②非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性Cl>C>Si,所以酸性:HClO4>H2CO3>H2SiO3;
(3)同周期主族元素自左至右第一电离能呈增大趋势,同主族元素自上而下第一电离能减小,所以第一电离能最小的元素是Al;非金属性越强电负性越大,四种元素中非金属性最强的是Cl元素,所以电负性最大的是Cl元素。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如图变化关系:

(1)A的名称是___;D的化学式是___。
(2)B→D反应的化学方程式___。
(3)A与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)D中官能团名称______________________。
(2)丙烯转化为A的反应类型为___________,A转化为B的反应类型为___________。
(3)E的化学名称为______________________。
(4)丙烯聚合为F的化学方程式是_________________________________
(5)写出C与银氨溶液反应的化学方程式________________________________________。
(6)E有多种同分异构体,其中一种能发生银镜反应,且核磁共振氢谱有五组峰,则该种同分异构体的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________

(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.

(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。

请回答下列问题:
(1)操作①的名称为________________、_________________;
(2)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是______________________;
(3)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是_______________________。
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要____________________,实验中温度计水银球所处位置为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com