
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
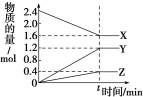
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取

试
(1)步骤2中加热方式____________(填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是____________________________________。
(2)步骤3中包含的实验操作名称____________________________。
(3)产品莫尔盐最后用_______洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。
![]()
(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为___________________________,验证推测的方法为:_____________________________________。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。

(2)①装置_______(填“甲”或“乙”)较为合理,判断理由是______________________。量气管中最佳试剂是___(填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气:
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为____________(不考虑立体结构),由A生成B的反应类型是____________反应;
(2)D的结构简式为_____________;
(3)由E生成F的化学方程式为_______________,E中官能团有_________(填名称),与E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(4)G的结构简式为_____________________;
(5)由I生成J的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量(mol) | 0.2 | 0.2 | 0 |
平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A. 反应可表示为2X+3Y![]() 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000
B. 增大压强使平衡向生成Z的方向移动,平衡常数增大
C. 若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D. 若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率 减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛在一定条件下可以两分子加成:RCH2CHO+RCH2CHO→![]() ,加成产物不稳定,受热即脱水而生成不饱和醛:
,加成产物不稳定,受热即脱水而生成不饱和醛:![]() +H2O,已知物质B是一种可作为药物的芳香族化合物,请根据下图(所有无机产物已略去)中各有机物的转化关系回答问题:
+H2O,已知物质B是一种可作为药物的芳香族化合物,请根据下图(所有无机产物已略去)中各有机物的转化关系回答问题:

(1)E的官能团名称:____;F的结构简式:_____;
(2)写出以下反应有机反应类型:C→E:___;D+G→H:___;
(3)写出下列反应的化学方程式:B﹢银氨溶液:____;D﹢G→H:___;
(4)F若与H2发生加反应,1molF最多消耗的H2的物质的量为____mol.
(5)符合下列条件的C的同分异构体有___种,其中一种的结构简式是_____.
a.属于芳香族化合物 b.苯环上有三个侧链 c.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-480.4kJ/mol ,则H2的燃烧热为ΔH=-240.2kJ/mol
B. 已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C. 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D. 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。![]() 与
与![]() 在水体和大气中的部分转化如下图所示。
在水体和大气中的部分转化如下图所示。

(1)碘在元素周期表的位置:______________________,其中一种人工放射性核素131I常用于甲亢的治疗,该核素含有的中子数为___________。
(2)结合元素周期律分析Cl-、I-的还原性强弱:同主族元素的原子,从上到下,____________。
(3)水体中的I-的非酸性条件下不易被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的
的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的![]() 氧化的原因是_____________________。
氧化的原因是_____________________。
(4)大气中的部分碘源于![]() 对海水中I-的氧化,有资料显示:水体中若含有
对海水中I-的氧化,有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
已知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂 组成 | 反应前溶液 的 | 反应后溶液 的 |
转化率 |
的生成量 |
A |
|
|
| 约 | —— |
B |
|
|
| —— | 少量 |
C |
|
|
| 约 | 大量 |
① a=__________。
② 用离子方程式解释A中pH增大的原因_______________________________________。
③ 写出B中产生![]() 的离子方程式_________________________________________。
的离子方程式_________________________________________。
④ C中实验进行20s后,发现溶液中![]() 浓度开始下降。导致下降的直接原因有_______。
浓度开始下降。导致下降的直接原因有_______。
A ![]() 减小 B
减小 B ![]() 减小 C
减小 C ![]() 不断生成
不断生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com