
【题目】用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于( )
A. 酸 B. 酸性氧化物 C. 碱性氧化物 D. 盐
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)===2NH3(g) △H=-92kJ/mol。起始反应物为![]() 和
和![]() ,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中
,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中![]() 的物质的量分数如下表:
的物质的量分数如下表:
温度 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中![]() 的物质的量分数越大,则正反应速率越大
的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时, ![]() 和
和![]() 的转化率均为1
的转化率均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成![]() 的物质的量最多
的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途不对应的是( )
A. 铝合金的密度小,硬度大,可用作建筑材料
B. 食品工业中用Na2CO3作焙制糕点的膨松剂
C. FeCl3溶液能与Cu反应,可用于腐蚀铜制印刷电路板
D. 明矾能生成Al(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为1.00L的容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的△H_______0(填“大于”“小于”);
②100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_________molL-1s-1反应的平衡常数K为__________。
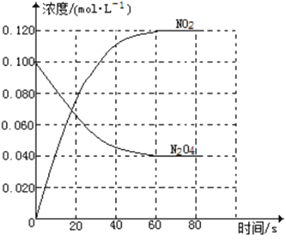
(2)在恒容密闭容器中通入X 并发生反应:2X(g) = Y(g);温度T1、T2下X的物质的最浓度c(X)随时间t 变化的曲线如图所示。
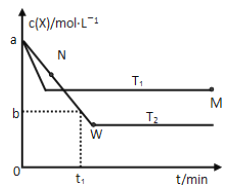
①T1____T2 (填“大于”或“小于”)。
②M点的正反应速率V正____N点的逆反应速率V逆(填“大于”,“小于”或“等于”)。
(3)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s) + Br2(g) ΔH= + 105. 4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列有关叙述正确的是
为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,22.4LH202中含有共价键的数目为3![]()
B. 4.6g甲苯(C7H8)和丙三醇(C3H803)的混合物中含有的氢原子数为0.4![]()
C. 50mL18.4molL-1浓硫酸与足量铜微热反应,转移的电子数目为0.92![]()
D. 已知 S02(g)+l/202(g)=S03(g) △H=-98.32 KJ.mol-1,则向容器中充入![]() 个 S02分子和0.5
个 S02分子和0.5![]() 个02分子在一定条件下充分反应,最终放出的热量为98.32 kJ
个02分子在一定条件下充分反应,最终放出的热量为98.32 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 三氧化硫溶于水能导电,所以它是电解质
B. 三氧化硫与氢氧化钡溶液、硝酸钡溶液都能反应生成沉淀
C. 三氧化硫能使石蕊试液先变红色,然后再变为无色
D. 硫粉在过量的纯氧气中燃烧生成三氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com