
| A. | 4mol | B. | 1mol | C. | 8mol | D. | 2mol |
分析 先根据化合价判断分析被氧化、还原的元素,然后根据反应方程式计算出生成3mol氯化铵时消耗氯气的物质的量,再利用电子守恒计算出被氧化的氨气的物质的量.
解答 解:反应3Cl2+8NH3=N2+6NH4Cl中,部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以Cl2是氧化剂,NH3是还原剂,当有3mol氯化铵生成时,反应消耗氯气的物质的量为:3mol×$\frac{3}{6}$=1.5mol,根据电子守恒,被氧化的氨气的物质的量为:$\frac{1.5mol×2}{0-(-3)}$=1mol,
故选B.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质与特征为解答结构,注意掌握电子守恒在氧化还原反应计算中的应用方法,试题培养了学生的化学计算能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cl2发生还原反应 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
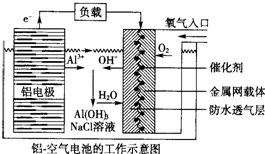
| A. | NaCl的作用是增强溶液的导电性 | |
| B. | 正极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 电池工作过程中,电解质溶液的pH不断增大 | |
| D. | 用该电池作电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
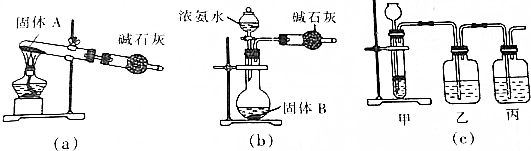
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成0.3molH2,被还原的水分子数目为0.6NA | |
| B. | 当有2.7gAl参加反应时,转移的电子数目为0.3NA | |
| C. | 每生成6.72L的H2,溶液中AlO2-的数目就增加0.2NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
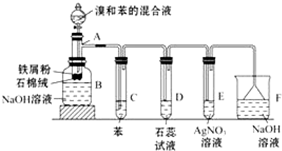 图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.
图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com